
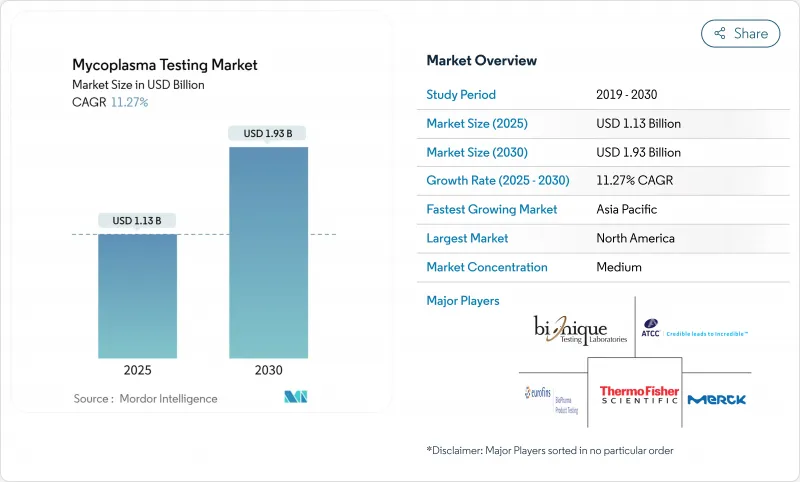
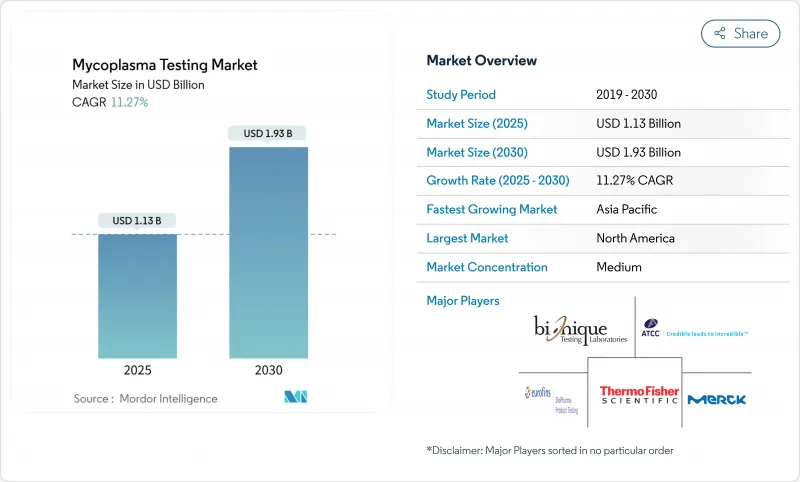
세계의 마이코플라스마 검사 시장 규모는 2025년에 11억 3,000만 달러로 추정 및 예측되어 예측 기간 중(2025-2030년) CAGR 11.27%로 확대되어, 2030년까지 19억 3,000만 달러에 달할 것으로 예측됩니다.
생물 제제 제조에 대한 규제 당국의 감시 강화, 세포 및 유전자 치료 생산의 확대, 신속한 핵산법에 대한 기호의 고조가 이 궤도를 지원하고 있습니다. FDA와 EMA로 대표되는 규제기관은 제품 수명주기의 여러 시점에서 유효한 마이코플라스마 검출을 요구하고 있으며, 바이오제조업체에게 컴플라이언스는 비재량적인 지출이 되고 있습니다. 디지털 PCR과 자동화된 sample-to-answer 플랫폼은 로트 릴리스 타임라인을 가속화하고, 아웃소싱 동향은 신속한 능력 확장이 가능한 위탁 기관에 검사 업무를 이전하고 있습니다. 중국, 인도, 싱가포르의 지역 제조업 확대는 세제 우대 조치와 함께 실험실 증설에 박차를 가하고 있지만, 숙련된 분자 QA 담당자의 부족과 높은 자동화 비용이 소규모 시설에서의 채용률을 억제하고 있습니다. 경쟁은 장비, 키트 및 서비스를 번들로 제공하고 크로스셀링 가능성을 높이고 고객과의 관계를 강화할 수 있는 공급업체에게 유리합니다.
자가 및 동종요법 공장의 생산 능력 향상으로 100% 배치 검사가 필요한 시료량이 증가하고 있습니다. 세포 배양에서 오염 유병률은 15%에서 35%이며, FDA 지침은 현재 풀링 후 세척 전 마이코플라스마 검사를 의무화하고 있으며 샘플링 빈도가 증가하고 있습니다. 연속 관류 생물반응기는 실시간 모니터링의 필요성을 높이고 최소한의 인적 개입으로 더 높은 처리량을 처리하는 자동 분석기 수요를 끌어올리고 있습니다. 신흥 시장에서의 시설 전개는 적격성 시험을 완료해야 하며, 제3자 시험 서비스에 대한 그린필드 수요를 창출합니다. 이러한 추세를 합하면 예측 CAGR은 2.8포인트 상승합니다.
FDA의 실험실 개발 시험 규칙과 EMA의 첨단 치료제 개발 지침은 마스터 셀 뱅크에서 최종 의약품에 이르기까지 유효한 분석을 요구합니다. 유럽 의약청(EMA)의 고급 치료제에 대한 지침은 마스터 셀 뱅크에서 최종 제품 출시에 이르기까지 제조 공정 전반에 걸쳐 종합적인 마이코플라스마 검사를 의무화하고 있습니다. 이러한 규제 변경은 제조업체가 검증된 방법으로 마이코플라스마가 존재하지 않는다는 것을 증명하지 않으면 제품을 출시할 수 없기 때문에 검사 서비스에 대한 비재량적 수요를 생성합니다. 새로운 LDT 규제가 4년에 걸쳐 점진적으로 시행됨에 따라 검사 시설이 컴플라이언스를 유지하기 위해 검사 능력을 업그레이드하여 예측 가능한 수요가 증가합니다.
엔트리 레벨 자동 분석기는 100,000-500,000 달러로 연간 서비스 계약은 50,000달러를 초과합니다. 소규모 CTL과 아카데믹 실험실에서는 이러한 지출을 정당화하는 데 어려움을 겪으며 수동 배양 방법에 대한 의존도를 늘립니다. FDA의 LDT 컴플라이언스는 검증 비용을 추가하고 자본 예산을 압박하여 단기 보급을 억제합니다. 소규모 검사 수탁 시설은 제한된 샘플 양과 다양한 검사 요구 사항으로 인해 자동화 투자를 정당화하는 데 특히 어려움을 겪고 있습니다. 규제 준수를 위한 자동화 시스템의 검증 복잡성은 검증 연구에 일반적으로 6-12개월이 걸리고 전문적인 전문 지식이 필요하기 때문에 많은 시간과 비용 부담이 강합니다.
보고서에서 분석된 기타 촉진요인 및 억제요인
키트 및 시약은 2024년에 46.17%의 점유율을 유지해 마이코플라스마 검사 시장에서 소모품으로서의 성질을 강조하고 있습니다. 바이오 제조업체가 방법 검증 및 루틴 스크리닝을 인증 실험실에 맡기기 때문에 서비스 부문은 CAGR 14.68%로 확대됩니다. 높은 규제 장애물과 진화하는 분석 형식으로 기업은 용량을 구축하는 대신 전문가의 용량을 구입하게 되었습니다. Eurofins의 45개가 넘는 세계적인 거점망은 개별 기업에서는 재현할 수 없는 비용 효율성을 어떻게 규모를 창출하는지를 보여줍니다.
자동화 대응 기기는 구매자가 시약의 장기 계약에 묶이기 때문에 꾸준하지만 성장은 완만합니다. BIOFIRE 플랫폼과 Rapid Micro Biosystems의 바이알 리더는 속도와 약전 컴플라이언스를 융합시켜 어필하고 있습니다. 서비스가 성장함에 따라 키트 벤더는 시약 렌탈 모델에서 타사 실험실과 협력하여 공급 수익을 보장합니다. 이 시너지 효과는 구매자와 공급자의 종속성을 강화하고 두 카테고리의 수량을 증가시킵니다.
qPCR은 2024년 마이코플라스마 검사 시장 점유율의 64.39%를 차지했습니다. 디지털 PCR은 16.26%의 성장률로 표준 곡선 오류를 줄이고 유전자 치료 로트에 필수적인 드문 이벤트를 감지합니다. 감도 향상은 확실한 정량을 요구하는 규제 감사관과 공명합니다. 기존 PCR 방법은 기존 시설에서 여전히 저렴한 비용의 선택이며 ELISA 및 DNA 염색법은 틈새 학술 응용 분야에서 여전히 적합합니다. 차세대 시퀀서는 다중 병원체 스크리닝을 약속하지만 규제 당국의 합의를 기다리고 있습니다.
규제기관은 현재, 배양과 동등한 핵산법을 릴리스 검사에 인정하고 있어 디지털 PCR의 보급을 촉진하고 있습니다. 장비 제조업체는 반응 혼합물을 수천 개의 파티션으로 슬라이스하고 검출 임계값을 낮추는 마이크로플루이딕스 칩 포맷에 투자하고 있습니다. 인공지능의 향상은 운영자의 기술 장벽을 줄여 더욱 광범위한 실험실 채용을 가능하게 합니다.
북미는 FDA의 감독, 성숙한 바이오프로세싱 인프라, 조기기술 도입이 안정된 수요를 뒷받침해 2024년 매출의 40.81%를 차지해 선두가 되었습니다. 이 지역의 바이오클러스터 밀도와 자본의 가용성은 배양 방법에서 자동 PCR 시스템으로의 신속한 교체를 촉진합니다. 서비스 제공업체는 혁신자에 가깝다는 장점을 활용하여 Just-In-Time 샘플 물류 및 규정 준수 감사를 가능하게 합니다.
유럽은 EMA에 의한 일관된 규제 프레임워크과 여러 국가에서의 로트 릴리스를 용이하게 하는 조화된 약전에서 추종하고 있습니다. 마이코플라스마 검사 시장 규모는 독일, 스페인, 영국이 GMP 시설을 보유한 EU의 유전자 치료 시험과 관련이 있습니다. 공급업체는 다국어 문서화 및 직렬화 요구에 부응하여 정보학 지원 분석 플랫폼에 박차를 가하고 있습니다.
아시아태평양은 가장 급성장하는 지역으로 CAGR 18.62%로 확대되고 있습니다. 중국의 세포요법 부문은 정부의 우선순위 목록의 혜택을 받고 있으며 인도의 생산 연동형 인센티브 제도는 백신 수출업체를 유치하고 있습니다. 싱가포르의 분산형 QC 실험실은 지역 생물 제제 공장의 납기를 단축합니다. 규제가 세분화되어 있어 현지에서의 검증이 필요하며, 서비스 허브를 병설하는 세계 기업이 유리하게 됩니다.
남미와 중동 및 아프리카는 절대적인 수익으로 후진을 겪고 있지만, 국내 백신 프로그램과 바이오시밀러 공장의 급증에 따라 미개척 업사이드를 제공합니다. 물류의 장애물과 제한된 콜드체인 인프라가 신속 PCR 장비의 보급을 늦추고 있지만 교육과 서비스 네트워크가 성숙하면 공중 보건에 대한 투자가 미래 주문을 이끌어 낼 수 있습니다.
The Mycoplasma Testing Market size is estimated at USD 1.13 billion in 2025, and is expected to reach USD 1.93 billion by 2030, at a CAGR of 11.27% during the forecast period (2025-2030).
Heightened regulatory scrutiny on biologics manufacturing, expanding cell- and gene-therapy production, and growing preference for rapid nucleic-acid methods underpin this trajectory. Regulatory agencies, led by the FDA and EMA, require validated mycoplasma detection at multiple points in the product lifecycle, turning compliance into a non-discretionary spend for biomanufacturers fda.gov. Digital PCR and automated sample-to-answer platforms accelerate lot-release timelines, while the outsourcing trend transfers testing workloads to contract organizations that can scale capacity quickly. Regional manufacturing expansions in China, India, and Singapore combine with tax incentives to spur laboratory build-outs, yet shortages of skilled molecular QA personnel and high automation costs temper adoption rates in smaller facilities. Competitive dynamics favor vendors able to bundle instruments, kits, and services, boosting cross-selling potential and consolidating customer relationships.
Capacity ramp-ups in autologous and allogeneic therapy plants have multiplied sample volumes that require 100% batch testing. Contamination prevalence in cell cultures ranges between 15% and 35%, and FDA guidance now mandates mycoplasma testing after pooling and prior to washing, increasing sampling frequency. Continuous perfusion bioreactors raise real-time monitoring needs, pushing demand for automated analyzers that handle higher throughputs with minimal human intervention. Facility roll-outs in emerging markets must complete qualification studies, creating greenfield demand for third-party test services. Together, these trends add 2.8 percentage points to the forecast CAGR.
The FDA's laboratory developed tests rule and EMA guidance for advanced therapy medicinal Products require validated assays from a master cell bank to a finished drug. The European Medicines Agency's guidelines for Advanced Therapy Medicinal Products mandate comprehensive mycoplasma testing throughout the manufacturing process, from master cell banks to final product release. These regulatory changes create non-discretionary demand for testing services, as manufacturers cannot release products without demonstrating mycoplasma absence through validated methods. Compliance spending accelerates through 2027 as phased LDT oversight takes effect.The phased implementation of new LDT regulations over four years creates predictable demand growth as laboratories upgrade their testing capabilities to maintain compliance.
Entry-level automated analyzers cost USD 100,000-500,000, with annual service contracts topping USD 50,000. Smaller CTLs and academic labs struggle to justify such outlays, prolonging reliance on manual culture methods. FDA LDT compliance adds validation costs and strains capital budgets, curbing near-term uptake. Smaller contract testing laboratories face particular challenges in justifying automation investments given their limited sample volumes and diverse testing requirements. The complexity of validating automated systems for regulatory compliance adds significant time and cost burdens, with validation studies typically requiring 6-12 months and specialized expertise.
Other drivers and restraints analyzed in the detailed report include:
For complete list of drivers and restraints, kindly check the Table Of Contents.
Kits and reagents maintained a 46.17% share in 2024, underlining their consumable nature within the Mycoplasma testing market. The Services segment is set to expand at 14.68% CAGR as biomanufacturers delegate method validation and routine screening to accredited laboratories. High regulatory hurdles and evolving assay formats encourage companies to buy expert capacity instead of building it. Eurofins' network of 45+ global sites illustrates how scale produces cost-efficiencies that individual firms cannot replicate.
Automation-ready instruments show steady but slower growth because purchasers often tie them to long-term reagent contracts. The BIOFIRE platform and Rapid Micro Biosystems' vial-reader appeal by blending speed with pharmacopeial compliance. As services grow, kit vendors align with third-party labs under reagent-rental models that lock in supply revenues. This synergy consolidates buyer-supplier dependencies and drives volume in both categories.
qPCR holds 64.39% of the 2024 Mycoplasma testing market share thanks to entrenched protocols and broad instrument availability. Digital PCR, with a 16.26% growth rate, mitigates standard-curve errors and detects rare events vital for gene-therapy lots. Sensitivity gains resonate with regulatory auditors seeking robust quantification. Conventional PCR remains a budget choice for legacy facilities, while ELISA and DNA staining stay relevant in niche academic applications. Next-generation sequencing promises multiplex pathogen screens but awaits regulatory consensus.
Regulatory bodies now accept nucleic-acid methods equivalent to culture for release testing, catalysing digital PCR uptake. Instrument makers invest in microfluidic chip formats that slice reaction mixes into thousands of partitions, lowering detection thresholds. AI augmentation further lessens operator skill barriers, unlocking broader lab adoption.
The Mycoplasma Testing Market Report Segments the Industry Into by Product (Instruments, Kits and Reagents, Services), Technology (Conventional PCR, QPCR, and More), Application (Cell-Line Quality Control, and More), End User (Biopharma and Biotechnology Companies, and More), and Geography (North America, Europe, Asia-Pacific, Middle East and Africa, South America). The Market Forecasts are Provided in Terms of Value (USD).
North America led with 40.81% of 2024 revenue as FDA oversight, mature bioprocessing infrastructure, and early technology adoption underpin stable demand. The region's biocluster density and capital availability encourage rapid replacement of culture methods with automated PCR systems. Service providers leverage proximity to innovators, enabling just-in-time sample logistics and compliance audits.
Europe follows with a cohesive regulatory framework from the EMA and harmonised pharmacopoeias that facilitate multi-country lot release. The Mycoplasma testing market size tied to EU gene-therapy trials rises as Germany, Spain, and the United Kingdom host GMP facilities. Vendors cater to multi-language documentation and serialization demands, spurring informatics-enabled assay platforms.
Asia-Pacific represents the fastest-growing arena, expanding at 18.62% CAGR. China's cell-therapy sector benefits from government priority listings, while India's production-linked incentive schemes attract vaccine exporters. Singapore's decentralized QC labs shorten turnaround times for regional biologics plants. Fragmented regulations necessitate local validation, favouring global companies that co-locate service hubs.
South America and the Middle East & Africa trail in absolute revenue but offer untapped upside as domestic vaccine programs and biosimilar plants proliferate. Logistics hurdles and limited cold-chain infrastructure slow penetration of rapid PCR devices, yet public-health investments could unlock future orders once training and service networks mature.