
검체 타당성 검사 시장 규모는 2025년에 23억 4,000만 달러로 추정되고, 2030년에는 32억 1,000만 달러에 이를 전망이며, CAGR 6.53%로 성장할 것으로 예측됩니다.

이 궤적은 직장 안전 의무 강화, 포인트 오브 케어(POC) 검사 플랫폼의 채택 가속, 고급 혼입 시도를 감지하는 기술 업그레이드를 반영합니다. 운송, 에너지, 헬스케어의 헬스케어 기업은 계속 검사 범위를 확대하고, 2025년 1월 펜타닐과 노르펜타닐을 포함한 연방 패널의 확대 등 정부의 갱신은 모든 검사실에 대한 무결성의 기준을 인상하고 있습니다. 원격 의료 이용 증가로 원격 수집 채널이 새롭게 개설되어 시료의 무결성을 실시간으로 검증하는 변조 방지 장치 및 AI 주도 분석에 대한 수요가 높아지고 있습니다. 소변 이외의 매트릭스가 인기를 끌고 있지만, 검체 타당성 검사 시장은 규제 환경에서 여전히 주류인 대량의 소변 프로그램에 의해 지원됩니다.
세계 6대륙의 규제 당국이 기업의 안전 규칙을 강화하고 고용주에게 약물의 유무뿐만 아니라 각 샘플의 진정성도 확인하도록 촉구하고 있습니다. 미국의 OSHA 지침, 캐나다의 위험물 운송 규칙, 오만 노동성의 석유 및 가스 검사 의무화는 시료의 유효성 검사 엄격화를 위한 집단적인 움직임을 뒷받침합니다. 선도적인 콩그로 매리트는 사고 후 소송 위험을 줄이기 위해 CoC 소프트웨어 및 MRO(Medical Review Officer) 모니터링을 표준 작업 절차에 통합합니다. 그 결과 온도 스트립, 산화제 분석 및 디지털 저장 시스템의 경상 매출이 증가하고 수요가 두 배로 증가합니다.
새롭게 승인된 핸드헬드 분석기는 6분 이내에 오염물 스크리닝을 완료했으며, 사고 후 조사에 필요한 '즉시성' 기준을 충족하게 되었습니다. 미국 식품의약국(FDA)에 의한 현장 펜타닐 측정기의 인가는 원스텝 POC컵에 유효성 체크를 통합하는 전례가 되었습니다. 고용주는 다운타임의 단축을 평가하고, 실험실은 불합격 샘플의 수를 줄이며, 청구 주기를 단축합니다. 공급업체는 규정 준수 보고서를 인쇄하는 모듈식 리더로 대응하여 소모품의 경상 수익을 향상시킵니다.
중소규모 의료 제공업체는 잘못된 샘플과 관련된 책임을 과소평가하기 쉽습니다. 설문 조사에 따르면 포인트 오브 케어 도입 장벽의 59%는 교육 및 품질 보증과 관련이 있으며 많은 클리닉이 온도 검증이나 비중 점검을 수행하지 않았습니다. 현재 보험 상환 정책에서는 유효성 문서가 없는 청구는 거부되지만 지식의 격차가 남아 있기 때문에 도입이 지연되고 있습니다.
제품은 2024년 매출의 66.67%를 차지했으며, 분석 키트, 산화제 시약, 크레아티닌 표준물질, 일회용 채혈컵의 소모품으로서의 성질에 지지되고 있습니다. 온도 표시 스트립은 특히 대규모 물류 및 에너지 기업에서 고속 교환 사이클을 만들었습니다. 그러나 고용주가 결과 해석과 규정 준수 감사를 MRO 컨설턴트 및 전문 검사 기관에 위임했기 때문에 2030년까지 연평균 복합 성장률(CAGR)은 7.21%로 성장이 전망됩니다. 의료 및 법률 환경에서는 체인 오브 캐스트 디 관리와 머신러닝 분석을 통합한 번들 서비스가 선호됩니다. 서비스 검체 타당성 검사 시장 규모는 2030년까지 12억 4,000만 달러에 달할 것으로 예상되며 소모품의 우위성에도 불구하고 기세를 유지하고 있습니다.
서비스 파도는 원격 수집 의료에도 타고 있습니다. 텔레헬스 플랫폼은 타사 실험실과 계약을 맺고 도착 시 시료의 온도와 산화제 수준을 확인하며, 당일 판정에 프리미엄 요금을 지불합니다. 국경을 넘어서는 고용 프로그램은 가상 MRO 검토에 대한 수요가 급증하고 대응 가능한 수익이 확대되고 검체 타당성 검사 시장은 제품 단체가 아닌 전체적인 솔루션으로 확고하게 되어 있습니다.
북미는 2024년에 41.34%의 매출을 유지했으며, 검체 타당성 검사 시장에 있어서 규제면에서의 페이스메이커로 계속합니다. 보건복지성은 규제 대상의 각 소변 검체에 대해 채취 직후 온도(32-38℃), pH(4.5-8.0), 비중(1.003 이상), 크레아티닌(20mg/dL 이상)을 기록할 것을 의무화하고 있습니다. 2025년 1월 패널 개정에서는 펜타닐과 노르펜타닐이 추가되었으며, 새로운 분석물 차단 하에서 위음성을 피하기 위해 실험실은 정확한 유효성 확인의 필요성을 더욱 높였습니다. 교통부의 병행 지침은 대략 1,000만 명의 안전이 중시되는 근로자에게 적용되며 대량 검사가 보장됩니다. 캐나다의 프라이버시 중심 프레임워크는 무작위 검사를 줄이지만 여전히 온도와 증거 서류의 체인에 의존하는 경구 유체 프로그램을 강조합니다.
아시아태평양에서 2030년까지 연평균 복합 성장률(CAGR)이 7.41%로 가장 빠르게 성장할 전망이며, 이는 중국과 인도의 다국적 공장이 미국 노동 안전 위생국(OSHA)의 베스트 프랙티스를 현지 오퍼레이션에 통합하고 있는 것에 뒷받침되고 있습니다. 세계적인 선도적인 진단자는 분석 키트를 공급하고 모국어로 MRO 서비스를 제공하는 지역 허브를 개설하고 있습니다. 국경을 넘어선 무역 컴플라이언스를 통해 기업은 미국식 CoC 시스템을 채택하여 시료 유효성 테스트 시장에 새로운 규모를 제공합니다. 지역 정부는 특히 수송 및 광업에서 시료 무결성 검사를 더욱 강화하는 약물 검사 의무화 방법을 연구하고 있습니다.
유럽에서는 규제가 단편화되고 있습니다. 독일의 철도 사업자는 미국 연방 정부의 지침을 준수하는 엄격한 시료 유효성 규칙을 적용하고 있지만, 프랑스는 검사를 안전성을 중시하는 역할로 제한하고 더 엄격한 개인 정보 필터를 부과합니다. EU의 체외 진단용 의약품 규제(IVDR)는 역내에 들어가는 유효한 기기에 성능과 시판 후 서베이런스의 의무를 부과하고 있어, 진입 장벽을 높이면서도 품질의 표준화를 도모하고 있습니다. 그러므로 범유럽 고용주는 바코드 무결성 씰과 클라우드 보관 로그를 통합한 CE 마크 수집 시스템에 기울고 있습니다.
중동 및 아프리카는 국제 석유 및 가스 계약 기준을 따릅니다. GCC 항공 규제 당국은 미국 SAMHSA 지침을 반영하는 CoC 프로토콜로 MRO의 유효성 검사를 요구합니다. 남아프리카의 광업소는 세계 시험소와 제휴하여 구매자의 기대에 부응하기 위해 높은 무결성 검사 기준을 마련하고 있습니다. 남미는 브라질이 이끌고 있습니다. 브라질에서는 법률 13.103/15에 따라 전문 운전자는 시료의 유효성을 문서화하는 등 정기적인 독물학적 평가를 받아야 합니다. 아르헨티나의 확대 자동차 부서는 공급망 파트너를 만족시키기 위해 미국 DOT 가이드라인을 수입하고 있습니다.
The specimen validity testing market size is valued at USD 2.34 billion in 2025 and is projected to reach USD 3.21 billion by 2030, advancing at a 6.53% CAGR.
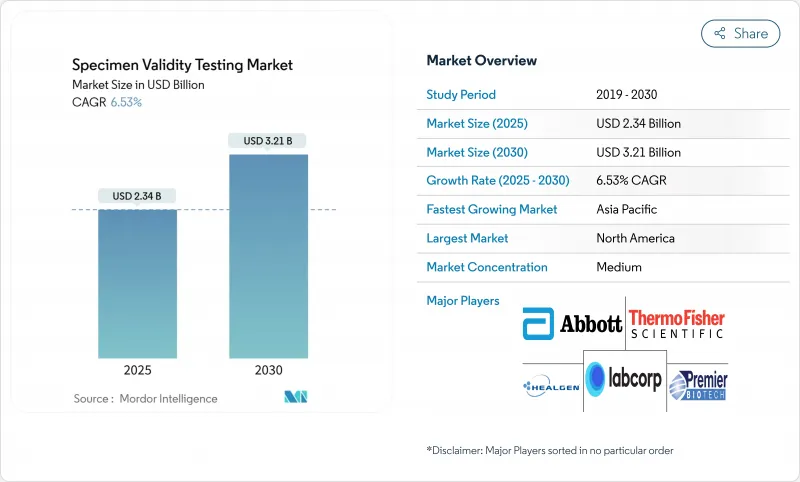
The trajectory reflects tightening workplace-safety mandates, accelerated adoption of point-of-care (POC) testing platforms, and technology upgrades that detect sophisticated adulteration attempts. Employers in transportation, energy, and healthcare continue to widen testing coverage, while government updates-such as the January 2025 federal panel expansion that now includes fentanyl and norfentanyl-raise the integrity bar for all laboratories. Rising telehealth use has also opened a new remote-collection channel, prompting demand for tamper-evident devices and AI-driven analytics that verify specimen integrity in real time. Although non-urine matrices are gaining favor, the specimen validity testing market remains buoyed by high-volume urine programs that still dominate regulated settings.
Regulators on six continents are strengthening corporate safety rules, pushing employers to verify not only drug presence but the authenticity of each sample. OSHA-aligned directives in the United States, Canada's Transportation of Dangerous Goods Regulations, and the Oman Ministry of Manpower's compulsory oil-and-gas testing order underscore a collective move toward stricter specimen validity checks. Large conglomerates increasingly embed chain-of-custody software and Medical Review Officer (MRO) oversight into standard operating procedures, mitigating litigation risk after accidents. The resulting demand multiplier lifts recurring sales of temperature strips, oxidant assays, and digital custody systems .
Newly cleared handheld analyzers now complete adulterant screens in under six minutes, meeting the "immediacy" standard required in post-incident investigations. U.S. Food and Drug Administration (FDA) clearance for on-site fentanyl assays has set a precedent for integrating validity checks into single-step POC cups. Employers value reduced downtime, while laboratories see fewer rejected samples, shortening billing cycles. Vendors respond with modular readers that print compliance-ready reports, reinforcing recurring consumable revenues.
Smaller healthcare providers often underestimate liability tied to invalid samples. Surveys highlight that 59% of point-of-care implementation barriers relate to training and quality assurance, leaving many clinics without temperature verification or specific-gravity checks. Reimbursement policies now deny claims lacking validity documentation, but knowledge gaps persist, slowing uptake .
Other drivers and restraints analyzed in the detailed report include:
For complete list of drivers and restraints, kindly check the Table Of Contents.
Products anchored 66.67% of 2024 revenue, sustained by the consumable nature of assay kits, oxidant reagents, creatinine standards, and single-use collection cups. Temperature-indicator strips alone generated a high-velocity replacement cycle, especially in large logistics and energy enterprises. Services, however, post a 7.21% CAGR through 2030 as employers outsource result interpretation and compliance audits to MRO consultants and specialty laboratories. Medical-legal environments favor bundled offerings that merge chain-of-custody management with machine-learning analytics. The specimen validity testing market size for services is forecast to reach USD 1.24 billion by 2030, maintaining momentum despite the dominance of consumables.
The services wave also rides on remote-collection medicine. Telehealth platforms contract third-party labs to verify sample temperature and oxidant levels on arrival, paying premium fees for same-day adjudication. Demand spikes for virtual MRO reviews in cross-border employment programs, broadening addressable revenue and solidifying the specimen validity testing market as a holistic solution rather than a product vertical alone.
The Specimen Validity Testing Market Report is Segmented by Product & Service (Products [Assay Kits, and More], Services), Type (Laboratory Testing, Rapid and POC Testing), End-User (Workplaces, Drug-Screening Laboratories, Pain-Management Centers, and More), and Geography (North America, Europe, Asia-Pacific, Middle East and Africa, South America). The Market Forecasts are Provided in Terms of Value (USD).
North America retained 41.34% revenue in 2024 and remains regulatory pacesetter for the specimen validity testing market. The Department of Health and Human Services requires each regulated urine specimen to document temperature (32-38 °C), pH (4.5-8.0), specific gravity (>=1.003), and creatinine (>=20 mg/dL) immediately after collection SAMHSA. The January 2025 panel revision, which added fentanyl and norfentanyl, further heightened laboratories' need for precise validity confirmation to avoid false negatives under new analyte cutoffs Federal Register. Parallel Department of Transportation mandates apply to roughly 10 million safety-sensitive workers, guaranteeing high test volumes. Canada's privacy-oriented framework reduces random testing but emphasises oral-fluid programs that still rely on temperature and chain-of-custody documentation for defensibility.
Asia-Pacific posts the fastest 7.41% CAGR through 2030, propelled by multinational factories in China and India that embed U.S. Occupational Safety and Health Administration (OSHA) best practices into local operations. Global diagnostic giants have opened regional hubs to supply assay kits and provide MRO services in native languages. Cross-border trade compliance drives companies to adopt U.S.-style chain-of-custody systems, giving the specimen validity testing market fresh scale. Regional governments are studying mandatory drug-testing statutes, particularly in transportation and mining, which would further embed specimen integrity checks.
Europe offers fragmented regulation. German rail operators apply stringent specimen-validity rules modelled on U.S. federal guidelines, whereas France limits testing to safety-sensitive roles and imposes stricter privacy filters. The EU's In Vitro Diagnostic Regulation (IVDR) imposes performance and post-market surveillance obligations on validity devices entering the bloc, raising entry barriers yet standardising quality. Pan-European employers thus lean toward CE-marked collection systems that integrate barcoded integrity seals and cloud custody logs.
The Middle East and Africa follow international oil-and-gas contracting standards. GCC aviation regulators require MRO-overseen validity checks, with chain-of-custody protocols mirroring U.S. SAMHSA guidelines. South Africa's mining houses partner with global laboratories to meet buyer expectations for high-integrity testing metrics. South America is led by Brazil, where Law 13.103/15 compels professional drivers to undergo periodic toxicological assessments that include specimen validity documentation; hair testing's popularity nonetheless demands cross-validation protocols to confirm authenticity. Argentina's expanding automotive sector imports U.S. DOT guidelines to satisfy supply-chain partners.