
의약품 CDMO 시장은 2025년의 1,844억 4,000만 달러에서 2026년에는 1,963억 3,000만 달러로 성장하여 2026년에서 2031년에 걸쳐 CAGR 6.45%를 나타낼 전망입니다. 2031년에는 2,683억 7,000만 달러에 달할 것으로 예상됩니다.

이 성장세는 업계가 핵심 창약 및 상업화 업무로 전략적으로 재조정하고 복잡한 생산 활동을 전문 파트너에게 맡기는 움직임에 기인하고 있습니다. 가상 바이오텍 기업으로의 벤처 캐피탈 유입, 첨단 치료법의 기록적 승인 건수, 고효율 API 파이프라인의 확대가 외부 생산 능력으로의 전환을 추진하고 있습니다. 한편, 비용 압력, 규제 당국의 감시 강화, 최첨단 기술의 필요성에 의해 대기업 제약 기업, 전문 기업, 제네릭 기업을 불문하고, 적격한 수탁 제조업자와의 제휴 심화가 진행되고 있습니다. 개발, 스케일업, 충전 및 마무리 서비스를 종합적으로 제공하면서 세계 품질 기준을 유지할 수 있는 공급자는 의약품 CDMO 시장에서 계속 큰 기회를 획득하고 있습니다.
FDA에 의한 2024년 사찰체제쇄신 후 컴플라이언스 비용이 급증하고 중규모 공장의 연간 품질 관련 비용은 200만-500만 달러 증가했습니다. 이 자본 부담으로 자원에 제약이 있는 스폰서 기업은 암 치료제이나 희귀질환 치료제 포트폴리오에서 전략적인 아웃소싱을 선택하는 경향이 있습니다. 개발과 상업화 기능을 통합한 수탁 제조 기업은 예측 가능한 파이프라인 유입의 혜택을 받는 한편, 종량 과금형과 리스크 분담형을 조합한 하이브리드 모델이 주목을 받고 있습니다.
다중특이적 항체, 항체 약물 복합체, 자가세포 요법은 독자적인 업스트림 세포 배양, 정제, 콜드체인 인프라를 필요로 하며, 자체 내 도입을 정당화할 수 있는 혁신 기업은 거의 없습니다. 삼성바이오로직스는 2024년 싱글유스 바이오리액터의 용량 확대에 24억 달러를 투자하고 현대적인 생물학적 제제 생산에 필요한 투자 규모를 나타냈습니다. 턴키 프로세스 개발, 바이러스 제거, 충전 및 마무리 서비스를 제공하는 공급자는 생물학적 제제의 수명주기 전반에 걸쳐 중요한 파트너가되었습니다.
복잡한 주사제에서 가동률이 85%를 넘고 리드타임이 18개월을 넘는 상황은 CDMO가 신규 바이오 의약품 프로그램을 흡수하는 능력을 제한하고 있습니다. 무균실, 첨단 로봇 기술, 직렬화 업그레이드에는 여러 해에 걸친 투자가 필요하며, 개선이 지연됨에 따라 단기적인 공급 핍박이 계속되고 가까운 미래의 수익 실현이 제약될 가능성이 있습니다.
2025년 시점에서 의약품 CDMO 시장 점유율의 41.98%를 원약 제조가 차지하고, 제네릭 의약품과 브랜드 의약품의 폭넓은 수요를 지지했습니다. 저분자 의약품의 생산량이 여전히 주류인 반면, 바이오의약품 및 고활성 원약(HPAPI)의 생산능력 증강에 의해 수익구성은 고부가가치 제품으로 이행되고 있습니다. 고객은 공급의 인계를 배제하기 위해 합성, 정제, 최종 제제 제조를 동일한 거점에서 제공하는 통합 서비스를 점점 요구하고 있습니다.
고형제와 주사제 모두 제제를 제공할 수 있는 위탁기업은 범위의 경제성을 누리고 있습니다. 디지털 직렬화, 연속 제조 및 예지 보전은 운영 비용 곡선을 재구성하고 진입 장벽을 새롭게 설정합니다. 포장 서비스, 특히 변조 방지 기능 및 추적 관리 솔루션과의 통합은 공급자를 더욱 차별화합니다.
2025년 수익에 차지하는 저분자 의약품의 비율은 여전히 56.85%였지만, 선진 의료 분야가 8.22%인 CAGR로 가장 급속한 확대를 이루었습니다. 개발자가 근치적 치료의 가능성을 추구하는 동안 바이러스 벡터 생산, 세포 배양 기술, 극저온 보존이 현재 설비 투자의 우선 사항을 지배하고 있습니다. 선진치료제용 의약품 CDMO 시장 규모는 승인제품의 자가이식에서 동종이식 프로세스로의 이행이 진행됨에 따라 확대가 예상되고, 보다 대규모로 표준화된 제조 공정이 요구됩니다.
바이오시밀러를 채택하고 새로운 항체 포맷을 통해 생물학적 제형은 중간 성장 단계에 있습니다. 모든 분자 클래스의 지속적인 투자는 CDMO가 단일 플랫폼 전문성이 아니라 다양한 기술 포트폴리오를 유지하는 것이 전략적으로 필수적이라는 것을 뒷받침합니다.
의약품 수탁 제조기관 보고서는 서비스 유형(원료제조 등), 약제 분자 유형(저분자, 생물학적 제제, 선진 치료 등), 조업 규모(임상 단계 제조 등), 최종 사용자(대형 제약 기업, 제네릭 의약품 기업 등), 치료 영역(종양학, 순환기 등), 지역별로 분류되어 있습니다. 시장 예측은 금액 기준(달러)으로 제공됩니다.
북미는 2025년 수익의 39.85%를 차지했으며, 견고한 지적재산권 틀, 의약품 개발 기업에 대한 근접성, 깊은 규제 전문 지식에 의해 지원되었습니다. 지속적인 생산과 세포요법 인프라에 대한 지속적인 투자로 인해 이 지역은 선호하는 파트너 기지로 남아 있지만, 높은 인건비가 증설 용량의 확대를 제한하고 있습니다.
아시아태평양은 8.91%의 연평균 복합 성장률(CAGR)로 가장 빠르게 성장하고 있으며, 중국, 인도, 한국의 대규모 투자가 견인하고 있습니다. 삼성바이오로직스의 24억 달러 규모의 확장계획은 이 지역이 최첨단 바이오의약품 생산능력에 주력하고 있음을 보여주는 좋은 예입니다. 통화 변동이나 진화하는 품질요구가 운영상의 과제가 되는 한편, 낮은 고정비와 정부의 우대조치가 의약품 CDMO 시장에서 같은 지역의 매력을 유지하고 있습니다.
유럽은 독일, 아일랜드, 스위스, 스칸디나비아에 확립된 클러스터로 안정적인 수요를 누리고 있습니다. 조화로운 유럽 의약청(EMA)의 규제는 특히 첨단 치료 분야에서 국경을 넘는 공급망을 촉진합니다. 중동 및 아프리카는 여전히 발전도상이지만, 각국 정부가 의약품의 안전보장과 현지제조의무를 추구하는 가운데 잠재성을 나타내고 있습니다.
The pharmaceutical contract manufacturing organization market is expected to grow from USD 184.44 billion in 2025 to USD 196.33 billion in 2026 and is forecast to reach USD 268.37 billion by 2031 at 6.45% CAGR over 2026-2031.
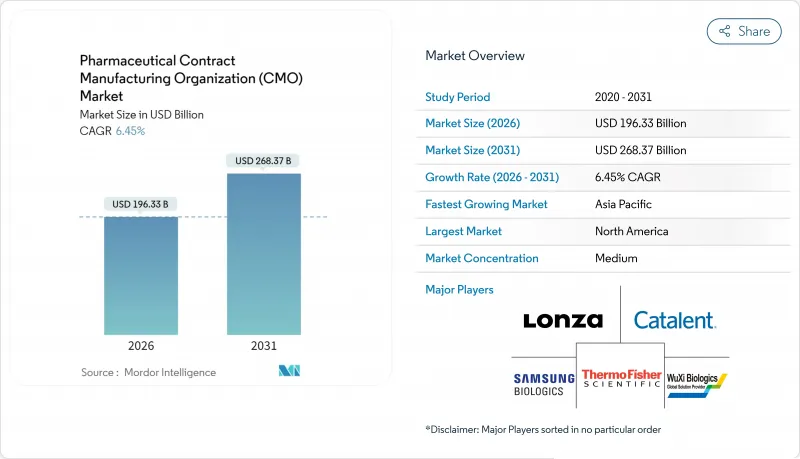
Momentum stems from the industry's strategic realignment toward core discovery and commercialization tasks, leaving complex production activities to specialized partners. Venture-capital inflows into virtual biotechs, record approvals of advanced therapies, and expanding high-potency API pipelines are reinforcing the shift toward external capacity. Meanwhile, cost pressures, regulatory scrutiny, and the need for state-of-the-art technologies are motivating big pharma, specialty players, and generics alike to deepen collaboration with qualified contract manufacturers. Providers able to bundle development, scale-up, and fill-finish services while maintaining global quality standards continue to capture disproportionate opportunities within the pharmaceutical contract manufacturing organization market.
Escalating compliance costs after the FDA's 2024 inspection overhaul elevated annual quality expenses by USD 2-5 million for mid-tier plants. The capital burden is steering resource-constrained sponsors toward strategic outsourcing across oncology and rare-disease portfolios. Contract manufacturers with integrated development and commercial capabilities benefit from predictable pipeline inflows, while hybrid fee-for-service and risk-sharing models are gaining traction.
Multi-specific antibodies, antibody-drug conjugates, and autologous cell therapies require distinctive upstream cell culture, purification, and cold-chain infrastructure that few innovators can justify in-house. Samsung Biologics committed USD 2.4 billion in 2024 to expand single-use bioreactor capacity, signaling the scale of investment necessary for modern biologics production. Providers offering turnkey process development, viral clearance, and fill-finish services are now critical partners across biologics life cycles.
Utilization above 85% and lead times exceeding 18 months for complex injectables limit CDMOs' ability to absorb new biologics programs. Sterile suites, advanced robotics, and serialization upgrades demand multi-year investments that delay relief, keeping short-term supply tight and potentially constraining near-term revenue realization.
Other drivers and restraints analyzed in the detailed report include:
For complete list of drivers and restraints, kindly check the Table Of Contents.
API manufacturing held 41.98% of pharmaceutical contract manufacturing organization market share in 2025, underpinning broad generic and branded drug demand. While small-molecule volumes stay dominant, biologics and HPAPI capacity additions are shifting revenue mix toward higher-value offerings. Clients increasingly seek integrated services that co-locate synthesis, purification, and final dosage manufacturing to eliminate supply handoffs.
Contractors offering both solid-dose and injectable dose formulation capture economies of scope. Digital serialization, continuous manufacturing, and predictive maintenance are reshaping operating cost curves, creating new competitive thresholds for entry. Integration with packaging services, particularly tamper-evident and track-and-trace solutions, further differentiates providers.
Small molecules still accounted for 56.85% of 2025 revenue, yet advanced therapies pushed the fastest expansion at an 8.22% CAGR. Viral vector production, cell expansion know-how, and cryogenic storage now dominate CAPEX priorities as developers chase one-time curative potential. The pharmaceutical contract manufacturing organization market size for advanced therapies is projected to broaden as more approved products transition from autologous to allogeneic processes, necessitating larger, standardized manufacturing runs.
Biologics occupy an intermediate growth position thanks to biosimilar adoption and novel antibody formats. Sustained investment across all molecule classes affirms the strategic imperative for CDMOs to maintain diversified technology portfolios rather than single-platform specialisms.
The Pharmaceutical Contract Manufacturing Organization Report is Segmented by Service Type (API Manufacturing, and More), Drug Molecule Type (Small Molecule, Biologics, and Advanced Therapies), Scale of Operation (Clinical-Phase Manufacturing, and More), End User (Big Pharma, Generic Pharma, and More), Therapeutic Area (Oncology, Cardiovascular, and More), and Geography. The Market Forecasts are Provided in Terms of Value (USD).
North America held 39.85% of 2025 revenue, supported by strong intellectual property frameworks, proximity to drug innovators, and deep regulatory expertise. Ongoing investment in continuous manufacturing and cell-therapy infrastructure keeps the region a preferred partner location, though high labor costs limit incremental capacity additions.
Asia-Pacific is the fastest-growing region at a 8.91% CAGR, propelled by scale investments in China, India, and South Korea. Samsung Biologics' USD 2.4 billion build-out exemplifies regional commitment to state-of-the-art biologics capacity. Currency volatility and evolving quality expectations pose operational challenges, yet lower fixed costs and government incentives sustain its attractiveness within the pharmaceutical contract manufacturing organization market.
Europe enjoys stable demand thanks to established clusters in Germany, Ireland, Switzerland, and Scandinavia. Harmonized EMA regulations foster cross-border supply chains, particularly in advanced therapies. Middle East and Africa remain nascent but show potential as governments pursue medicine security and local manufacturing mandates.