
소아 임상시험 시장 규모는 2025년에 200억 2,000만 달러로 평가되었고, 2030년에 259억 8,000만 달러에 이를 것으로 예측되며, CAGR은 5.35%를 나타낼 전망입니다.
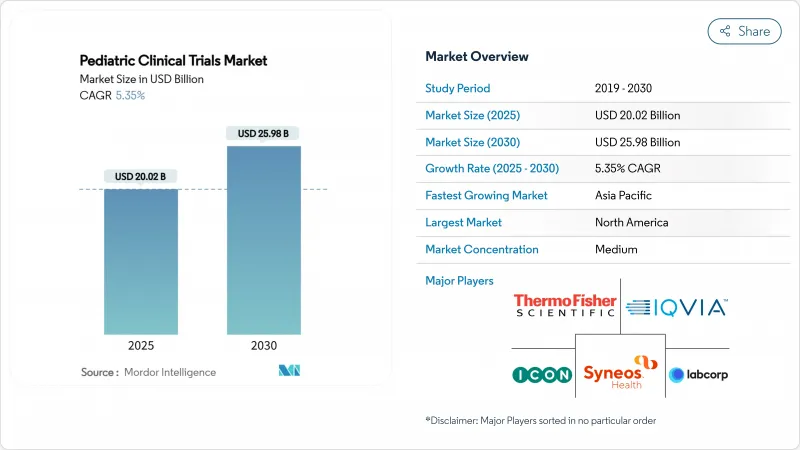
강력한 규제 인센티브, 특히 미국의 소아 연구 평등법(PREA)과 EU 소아 규정이 어린이를 대상으로 하는 모든 신약이 연령에 적합한 증거를 제시해야 하므로 임상시험 건수를 지속적으로 증가시키고 있습니다. 소아암 치료제 조기 평가 의무화(RACE for Children Act)는 암 중심 프로토콜의 높은 비중을 유지합니다. 아동 만성질환 유병률 증가, 분산형·AI 기반 연구 설계로의 전환, 소아 전문 CRO(계약연구기관)로의 심화된 아웃소싱 등 병행되는 추세들은 소아 임상시험 시장의 범위와 지리적 확장성을 동시에 확대하고 있습니다. 북미는 여전히 최대 지역 거점이지만, 한국·대만·호주 규제당국의 심사 절차 간소화 및 스폰서 대상 재정적 인센티브 도입으로 아시아태평양 지역의 성장 속도가 가장 빠릅니다.
오랜 기간 시행된 의무 사항들은 유럽의 소아 임상시험계획(Pediatric Investigation Plans) 및 미국의 PREA(소아용의약품연구법)에 따른 소아 연구 계획의 요구를 통해 의약품 개발 경제성을 재편했습니다. FDA가 2024년 ICH E11A 외삽 가이드라인을 수용하며 과학적으로 타당할 경우 성인 데이터를 활용한 간소화된 용량 결정이 가능해지면서 융합이 지속되고 있습니다. 이러한 정책은 성인에서 소아로의 순차적 개발 일정을 단축시켜 특수 소아 프로토콜 수요를 증가시키며, 2025년 소아 의약품 혁신법(Innovation in Pediatric Drugs Act)은 강화된 시행을 제안하여 지속적인 성장을 예고합니다.
미국 조사 자료에 따르면 청소년의 천식 및 정신건강 진단이 지속적으로 증가하여 소아 호흡기, 내분비, 신경계 치료제 파이프라인이 직접 확대되고 있습니다. 천식만으로도 비히스패닉 흑인 아동에게 불균형적인 부담을 계속 가중시키고 있어, 전향적 연구가 해결하기 시작한 형평성 격차를 부각시킵니다. 만성 소아 질환의 특징인 조기 발병과 장기 치료 기간은 아동 친화적 제형과 강력한 장기 안전성 데이터 세트의 필요성을 증폭시키며, 이는 종합적으로 소아 임상시험 시장을 활성화합니다.
부모 동의와 연령에 적합한 동의(assent)라는 이중 요건은 연구 시작을 지연시키고 비용을 증가시킬 수 있는 추가적인 행정적 절차를 도입합니다. 캐나다 다기관 설문조사에 따르면 PICU 입원 후 48시간 내 동의 획득 가능성에 대한 인식 차이가 컸습니다. 국제 임상시험은 기관윤리심의위원회(IRB) 간 차이로 인해 추가적 어려움을 겪습니다. PARITY 정형외과 종양학 연구는 자원 제약으로 관심 기관 91곳 중 46곳에서만 승인을 획득했습니다. 표준화된 동의서 양식과 전자 문서화가 점차 이 부담을 완화하고 있으나, 소아 임상시험 시장에 대한 역풍으로 남아 있을 것입니다.
2024년 소아 임상시험 시장 규모에서 2상 시험이 40.51%로 가장 큰 비중을 차지했습니다. 이는 스폰서들이 개념 증명(proof-of-concept) 결과를 활용해 연령에 적합한 투여량 및 환자 모집 전략을 세밀하게 조정했기 때문입니다. RACE 법안과 ICH E11A 프레임워크에 힘입어 진행되는 1상 시험은 스폰서들이 소아 대상 기전 기반 치료제 시험을 조기에 진행함에 따라 2030년까지 연평균 7.25% 성장률을 보일 것으로 예상됩니다. 적응형 모델 기반 용량 증량 설계는 노출을 최소화하면서 진행/중단 결정 속도를 높여주며, 이는 현재 종양학 및 희귀 대사 장애 분야에서 표준화된 관행입니다.
3상 프로그램은 여전히 허가 표시를 위한 핵심이지만, 외삽 데이터에 대한 의존도 증가로 무작위 배정 코호트 규모를 축소할 수 있게 되었습니다. 그 결과, 3상 임상시험의 소아 임상시험 시장 점유율은 절대적 연구 건수가 증가함에도 비례적으로 소폭 감소할 수 있습니다. 만성 치료제의 경우 평생 노출로 인해 발달 단계 전반에 걸친 약물감시(pharmacovigilance)가 필요해지면서, 성장 및 신경인지적 종결점을 포착하기 위해 실제 세계 데이터와 등록 자료를 활용하는 시판 후 4상 감시(surveillance)가 확대되고 있습니다.
2024년 소아 임상시험 시장 점유율에서 중재적 약물 프로토콜이 65.53%를 차지했으며, 이는 아동 특이적 약동학 및 안전성 데이터에 대한 규제 요구를 반영합니다. 관찰적 단면 연구는 2030년까지 7.85%의 가장 빠른 연평균 성장률(CAGR)을 기록할 전망인데, 이는 규제 당국이 특히 무작위 시험이 불가능한 초희귀 질환 분야에서 보충적 라벨링을 뒷받침하는 실세계 증거를 수용함에 따른 결과입니다.
장치 중재는 건수로는 적지만, 영아에서 센서 정확도와 경보 임계값을 검증해야 할 필요성에 힘입어 당뇨병 기술 및 신경 모니터링 분야에서 꾸준히 증가하고 있습니다. 행동 및 코호트 연구는 복약 순응도 패턴, 학교 출석률 영향, 소아 임상 시험 산업에서 종합적인 위험-이익 평가에 중요한 심리사회적 결과를 특성화함으로써 약물 시험을 보완합니다.
북미는 PREA(소아 임상시험법)에 따른 의무화, 어린이 병원 밀집 네트워크, 시험 관련 절차에 대한 안정적인 보험 적용 등으로 2024년 소아 임상시험 시장의 39.32%를 차지했습니다. 루리 어린이 병원의 2026년 전문 약국 개설 계획과 같은 기관 역량 강화 이니셔티브는 연구-치료 통합 모델을 공고히 합니다. 인력 부족은 지속되나 원격 모니터링 도입 및 현장 지원 제휴를 통해 완화되고 있습니다.
아시아태평양 지역은 2030년까지 연평균 7.61% 성장률을 기록할 전망입니다. 한국의 중앙 집중식 IRB 심사, 대만의 신속 승인 절차, 호주의 분산형 임상시험 지침(시작 기간 최대 3개월 단축)이 이를 견인합니다. 중국의 국가 희귀질환 목록 확대 및 지방 의뢰 네트워크 투자는 환자 풀을 더욱 확대합니다. 운영 비용 절감과 의료 기록의 급속한 디지털화는 다국적 스폰서들의 환자 모집 다각화 목표에 부합하는 지역 매력도를 높입니다.
유럽은 소아과위원회(PDCO)를 통한 규제 환경의 조화로 혜택을 보며 학계-산업계 협력을 공고히 유지합니다. 그러나 브렉시트 이후 규제 차이 발생으로 영국 사이트에 대한 중복 제출이 요구되어 EU27 대비 일정이 지연됩니다. 라틴 아메리카 및 중동과 같은 신흥 지역은 정부가 연구 인프라를 업등급하고 세제 혜택을 도입함에 따라 점진적인 성장을 보이고 있지만, 소아과 전문의 밀도가 제한적이어서 현재로서는 복잡한 임상시험 수행이 제약받고 있습니다.
The pediatric clinical trials market size stands at USD 20.02 billion in 2025 and is forecast to reach USD 25.98 billion by 2030, registering a CAGR of 5.35%.
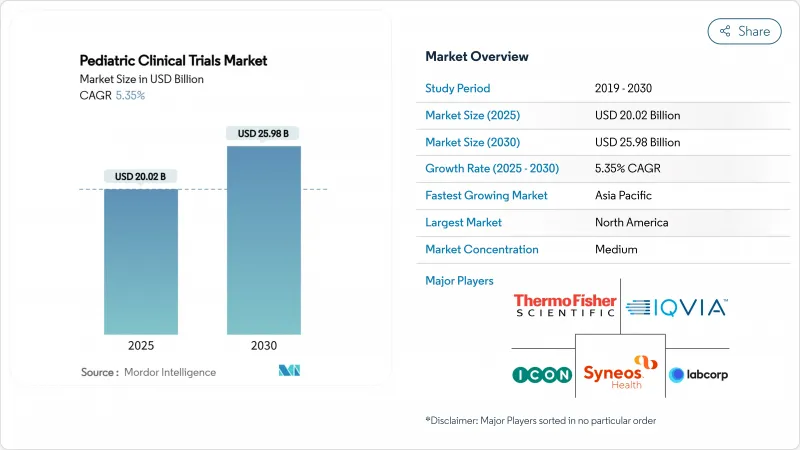
Strong regulatory incentives, notably the US Pediatric Research Equity Act (PREA) and the EU Paediatric Regulation, keep trial volumes rising as every new molecular entity targeting children must present age-appropriate evidence. Mandatory early evaluation of oncology drugs under the RACE for Children Act sustains a high share of cancer-focused protocols. Parallel trends-including rising chronic disease prevalence among children, the shift toward decentralized and AI-enabled study designs, and deeper outsourcing to pediatric-specialist contract research organizations (CROs)-are expanding both the scope and geographic reach of the pediatric clinical trials market. North America remains the largest regional hub, but Asia-Pacific is accelerating fastest as regulators in South Korea, Taiwan, and Australia streamline review pathways and introduce fiscal incentives for sponsors.
Long-standing mandates have reshaped drug-development economics by requiring Pediatric Investigation Plans in Europe and pediatric study plans under PREA in the United States. Convergence continues with the FDA's 2024 acceptance of ICH E11A extrapolation guidelines, enabling streamlined dose-finding that leverages adult data where scientifically justified. These policies reduce sequential adult-to-child timelines, lifting demand for specialized pediatric protocols, and the 2025 Innovation in Pediatric Drugs Act proposes stronger enforcement, signaling durable growth.
US survey data show persistent increases in asthma and mental-health diagnoses among youth, directly expanding the therapeutic pipeline for pediatric respiratory, endocrine, and neurological agents. Asthma alone continues to impose disparate burdens on non-Hispanic Black children, highlighting equity gaps that prospective studies are beginning to address. The earlier onset and longer treatment windows typical of chronic childhood diseases amplify the requirement for child-friendly formulations and robust long-term safety datasets, prompts that collectively boost the pediatric clinical trials market.
Dual requirements for parental permission and age-appropriate assent introduce added administrative layers that can delay study start-up and drive costs. A multicenter Canadian survey found wide divergence in feasibility perceptions for obtaining assent within 48 hours of PICU admission. International trials face further institutional review board variation; the PARITY orthopedic oncology study secured approvals from only 46 of 91 interested sites due to resource constraints. Harmonized consent templates and electronic documentation are gradually easing this burden but will remain a headwind for the pediatric clinical trials market.
Other drivers and restraints analyzed in the detailed report include:
For complete list of drivers and restraints, kindly check the Table Of Contents.
Phase II maintained the largest slice of the pediatric clinical trials market size at 40.51% in 2024 as sponsors used proof-of-concept readouts to fine-tune age-appropriate dosing and accrual strategies. Phase I trials, spurred by the RACE Act and ICH E11A framework, are projected to deliver a 7.25% CAGR by 2030 as sponsors move earlier to test mechanism-based therapies in children. Adaptive, model-based escalation designs minimize exposure while accelerating go/no-go decisions-a practice now standard in oncology and rare metabolic disorders.
Phase III programs remain pivotal for labeling, yet heightened reliance on extrapolation data permits smaller randomized cohorts. As a result, Phase III's proportional pediatric clinical trials market share could erode marginally even though absolute study counts rise. Post-marketing Phase IV surveillance is expanding for chronic therapies where lifetime exposure necessitates pharmacovigilance across developmental stages, leveraging real-world data and registries to capture growth and neurocognitive endpoints.
Interventional drug protocols held 65.53% pediatric clinical trials market share in 2024, reflecting regulatory imperatives for child-specific pharmacokinetic and safety data. Observational cross-sectional studies will contribute the fastest 7.85% CAGR to 2030 as regulators accept real-world evidence to support supplemental labeling, especially in ultra-rare diseases where randomized trials are infeasible.
Device interventions, although smaller in count, are rising steadily in diabetes tech and neuromonitoring, propelled by the need to validate sensor accuracy and alert thresholds in infants. Behavioral and cohort studies complement drug trials by characterizing adherence patterns, school attendance impacts, and psychosocial outcomes critical to holistic benefit-risk assessment in the pediatric clinical trials industry.
The Pediatric Clinical Trials Market Report is Segmented by Phase (Phase I, Phase II, Phase III, and Phase IV), Study Design (Interventional - Drug, Interventional - Device and More), Therapeutic Area (Respiratory Diseases, Infectious Diseases, Oncology, Diabetes and More), Sponsor Type (Pharma & Biopharma Companies and More), and Geography (North America, Europe and More). The Market Forecasts are Provided in Terms of Value (USD).
North America commanded 39.32% of the pediatric clinical trials market in 2024 due to PREA-driven mandates, a dense network of children's hospitals, and reliable reimbursement for trial-related procedures. Institutional capacity initiatives, such as Lurie Children's plan to open a specialty pharmacy in 2026, reinforce integrated research-to-care models. Staffing shortages persist but are mitigated by remote-monitoring adoption and site-support alliances.
Asia-Pacific will post a 7.61% CAGR through 2030, buoyed by South Korea's centralized IRB review, Taiwan's fast-track approvals, and Australia's decentralized trial guidelines that slash start-up times by up to three months. China's expansion of its National Rare Disease List and investment in provincial referral networks further enlarge patient pools. Lower operational costs and rapidly digitizing healthcare records enhance the region's attractiveness to multinational sponsors aiming to diversify recruitment.
Europe benefits from a harmonized regulatory environment via the Paediatric Committee (PDCO) and maintains robust academic-industry collaboration. Still, post-Brexit regulatory divergence demands duplicate submissions for UK sites, prolonging timelines compared with EU27. Emerging regions such as Latin America and the Middle East show incremental gains as governments upgrade research infrastructure and introduce tax incentives, but limited pediatric specialist density constrains complex trial execution for now.