
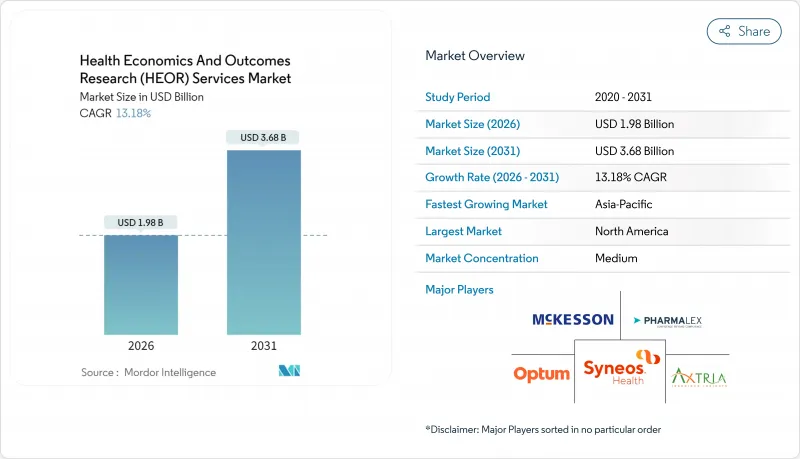
보건 경제 및 성과 연구(HEOR) 서비스 시장은 2025년 17억 5,000만 달러에서 2026년 19억 8,000만 달러로 성장하고 2026년부터 2031년에 걸쳐 CAGR 13.18%로 성장을 지속하여 2031년까지 36억8,000만 달러를 달성할 전망입니다.

환급 심사의 엄격화, 가치 기반 지불 모델로의 전환, 의료 기술 평가(HTA)의 의무화 확대는 보다 신속하고 설득력 있는 증거 패키지에 대한 수요를 촉진하고 있습니다. 생성형 AI는 문헌 검토의 사이클 타임을 60% 단축하고 프로젝트의 경제성을 재구축함과 동시에 조기 지불자 참여를 가능하게 합니다. 다국적 제약 회사의 파이프라인에서는 특히 비만 치료, 종양학 및 유전자 치료 분야에서 높은 비용 효과 모델링에 대한 지속적인 요구가 발생하고 있습니다. 서비스 제공업체는 연합 실사용 데이터(RWD) 네트워크에서 거대 언어 모델을 배포하여 프라이버시 보호 방침을 위반하지 않고 여러 관할 구역에 걸친 증거를 획득하고 있습니다. 치료 분야에 대한 깊은 지식과 AI를 통한 워크플로 자동화를 결합하는 공급자는 고객이 임상에서 경제성까지의 통합 증거 생성을 위해 공급업체 패널을 통합하는 가운데 경쟁 우위를 확대하고 있습니다.
지급기관은 프리미엄 가격 및 보험 적용 조건을 정당화하기 위해 실세계 유효성 데이터에 대한 요구를 강화하고 있습니다. FDA가 2024년에 발표한 지침에서는 규제 판단에 있어서 전자의무기록(EHR) 및 청구 데이터의 활용을 추천하고, RWD를 주요한 근거원으로 확고하게 자리매김했습니다. 메디케어 메디케이드 서비스 센터(CMS)는 성과 연동 계약 구조의 대상 치료 영역을 2023년 대비 40% 확대하여 성숙한 RWE 프로그램이 없는 제조업자의 경각심을 높이고 있습니다. 유럽의 HTA 규제는 다국적 기업의 신청 서류에 27개 회원국에 걸친 비교 유효성 데이터의 기재를 의무화함으로써 제2의 컴플라이언스 계층을 추가합니다. 이러한 규제는 종합적으로 분산된 청구 데이터, 레지스트리 데이터 및 의료기기 원격 측정 데이터를 지불자를 위한 경제적 내러티브로 변환할 수 있는 분석 플랫폼으로의 예산 이동을 촉진합니다. 전문 RWE 기업이 제시하는 프리미엄 가격 설정은 출시 후 가격 협상에 앞서 스폰서가 증거 격차를 메울 필요성을 돋보이게 합니다.
세계의 HTA 기관은 현재 전통적인 QALY당 비용 기준을 초과하는 보다 광범위한 사회적 가치 기준을 사용하여 치료법을 평가하고 있습니다. 2025년 1월부터 시행된 EU 공동임상평가(JCA)는 종양학 및 선진의료기술(ATMP)을 위한 조화된 증거 자료를 확립하면서 회원국의 가격 결정권을 인정하고 있습니다. 일본, 한국, 중국은 HTA 심사 제도를 강화하고 예산 영향과 환자보고 결과를 통합합니다. 프랑스 국립보건청의 2025-2030년 로드맵에서는 제조업체 제출 자료의 심사에 AI 스크리닝 툴을 우선적으로 도입하여 평가기관 내부의 디지털 전환을 추진하고 있습니다. 미국에서는 대체 지불 모델에 참여하는 병원 시스템이 치료 수준의 비용 효과를 입증해야 하며 의료 제공자 주도의 연구 결과 구매가 가속화되고 있습니다. 조사 기법에 대한 기대가 높아짐에 따라 스폰서는 공인 약물경제학자 및 다국적 데이터 권리를 보유한 전문 컨설턴트에 대한 의존을 강화하고 있습니다.
업계 조사에 따르면 수요가 학술계 공급을 능가하기 때문에 2030년까지 자격을 갖춘 의료경제학자가 세계적으로 35% 부족할 것으로 예측되고 있습니다. Axtria사 단독으로만 모델링 능력 강화를 위해 인도에서 1,000명의 데이터 사이언티스트를 도입할 계획입니다. 임금 프리미엄 상승과 프로젝트 리드타임의 장기화로 매출 수요가 가속화되는 반면 서비스 제공업체의 이익률은 압박되고 있습니다. 세포 치료 모델링과 같은 전문 분야는 특히 심각한 영향을 받고 있습니다. 표준 약물경제학 커리큘럼이 치료법의 혁신보다 뒤처져있기 때문에 기업은 임상 통계사에게 가치 평가 프레임워크를 재교육해야 합니다.
실세계 데이터 분석 및 정보 시스템은 2025년에 37.35%의 수익 점유율을 차지하였고, 일상 진료 데이터에 근거한 확고한 경제 평가를 스폰서가 요구하는 경향을 반영하고 있습니다. 컨설팅 회사와 CRO는 결제 데이터 레지스트리 웨어러블 데이터를 거의 실시간으로 쿼리할 수 있는 확장 가능한 클라우드 아키텍처에 투자하여 증거 주기를 줄이고 수동 데이터 추출을 줄이고 있습니다. 규제 당국에 의한 RWD의 명확한 지지도 이 부문의 촉진요인이 되며 FDA의 지침이 후기 단계의 생명공학 개발 기업에서의 구매 결정을 가속화하고 있습니다. 경쟁 압력도 혁신을 촉진하고 있습니다. IQVIA는 2024년 자사의 HTA Accelerator를 '마켓 액세스 인사이트'로 리브랜딩하여 신청 서류 자동화와 예산 영향 시뮬레이션을 통합했습니다. 향후 자동화 플랫폼의 도입, 지역 데이터 액세스 제휴, 지불자 심사 피드의 통합이 진행됨으로써 스폰서가 출시 후의 실세계 퍼포먼스 감시를 강화하는 가운데, 본 부문은 보건 경제 및 성과 연구 서비스 시장 전체를 웃도는 성장을 유지할 전망입니다.
시장 액세스 및 환급 서비스는 2031년까지 연평균 복합 성장률(CAGR) 16.82%로 가장 빠르게 성장하는 서비스 부문으로 예상됩니다. HTA의 엄격화와 지역별 지불자 규정의 차이로 인해, 특히 수십 년에 걸쳐 가치가 전개되는 단일 치료제에서 지속적인 효과 재평가가 요구되고 있습니다. 각 공급업체는 정가 재협상 임계값 초과를 감지하는 정책 트래커 및 시나리오 엔진을 통합하여 고객이 처방약 목록에서 제외되는 위험을 예방할 수 있도록 뒷받침합니다. 경제 모델링 및 평가는 여전히 필수적이며 첨단 마이크로 시뮬레이션과 분할 생존 모델이 거의 모든 HTA 신청의 기반이 되었습니다. 임상 결과 조사는 보다 풍부한 환자 보고 결과를 획득하는 분산형 시험 방법의 보급에 의해 촉진되고 있습니다. 이러한 동향은 종합적으로, 구매측이 단일 계약내에서 RWD 수집, 조사 방법 설계 및 정책 대응을 종합적으로 수행 가능한 통합 파트너에 집중되고 있음을 나타내고 있습니다.
본 '보건 경제 및 성과 연구(HEOR) 서비스 시장 보고서'는 서비스별(경제 모델링 및 평가, 실세계 데이터 분석 및 정보 시스템 등), 서비스 제공업체별(컨설팅 기업 등), 최종 사용자별(생명공학 및 제약 기업 등), 지역별(북미, 유럽, 아시아태평양, 중동 및 아프리카, 남미)으로 분류되어 있습니다. 시장 예측은 금액 기준(달러)으로 제공됩니다.
북미는 2025년에 45.95%의 수익 점유율을 차지하였고 견고한 경제적 증거를 요구하는 선진 환급 제도에 뒷받침되고 있습니다. FDA의 RWD 프레임워크 검증은 분석 지출을 촉진하고 미국을 조사 기법 기준의 기준 시장으로 확고히 하고 있습니다. 캐나다에서는 CADTH(캐나다 의료기술평가기관)가 캐나다 의약품청으로 통합되어 국가 수준의 HTA(의료기술평가) 능력이 강화되었습니다. 이로 인해 전문의약품에 대한 경제적 검증이 확대될 것으로 예측됩니다. 데이터 사이언스 인력 부족과 임금 상승이 지역 성장을 억제할 가능성이 있지만, 파이프라인의 활성화가 HEOR(보건 경제 및 성과 연구) 업무량과 직결되기 때문에 중기적인 확대는 견조하게 추이할 전망입니다.
아시아태평양은 2031년까지 연평균 CAGR 17.93%로 가장 빠른 성장을 보이며 임상시험 건수 증가, 약가 개혁, 디지털건강기반 강화가 견인역이 될 전망입니다. 일본의 2025년 약가 개정에서는 환급이 실제 이용 상황과 연동하기 때문에 제약 기업은 예산 영향의 사전 추적을 적극적으로 요구할 전망입니다. 중국 국가약품감독관리국(NMPA)의 ICH 가이드라인 준거로 세계 신청 서류의 공통성은 높아지고 있지만, 지방 입찰 규칙은 여전히 지방 수준에서의 근거를 요구하고 있습니다. 인도의 실세계 데이터(RWD) 네트워크 파일럿 사업은 보다 광범위한 민족적 대표성을 요구하는 다국적 기업에게 비용 효율적인 데이터 소스를 제공합니다. 서비스 제공업체는 데이터 현지화 법규를 준수하기 위해 직원 현지화 및 병원 컨소시엄과의 데이터 라이선싱 제휴를 추진하고 있습니다. 유럽은 27개 회원국에서 신청서류의 임상효과요소를 표준화하는 공동임상평가(JCA)의 신규 운영에 의해 여전히 큰 점유율을 유지하고 있습니다. 신청서류의 통일화에 의해 중복이 줄어들지만 각국 지불기관은 가격 설정의 자율성을 유지하고 있고, 스폰서는 국가별 예산 영향 분석을 요구받고 있습니다. 프랑스 국립보건총국(ANSM)의 AI 평가 프로그램은 알고리즘 지원형 평가의 선례를 확립하고 AI 대응 신청 서류의 심사 기간 단축의 가능성을 나타내고 있습니다. 중동, 아프리카 및 남미에서는 다양한 동향이 나타나고 있습니다. 사우디아라비아는 관리형 도입 계약을 운용하기 시작하였고 HEOR의 전문 지식을 활용하여 리스크 분담 계약을 구축하고 있습니다. 브라질의 사법기관은 환자 소송 안건의 대부분에서 부정적인 HTA 권고가 뒤집어지기 때문에 불확실성이 발생하여 광범위한 시나리오 모델링이 요구되고 있습니다. 다양한 증거 규칙을 습득한 벤더는 지불자 시스템의 성숙에 따라 큰 성과를 얻을 전망입니다.
The Health Economics And Outcomes Research Services market is expected to grow from USD 1.75 billion in 2025 to USD 1.98 billion in 2026 and is forecast to reach USD 3.68 billion by 2031 at 13.18% CAGR over 2026-2031.
Heightening reimbursement scrutiny, the shift to value-based payment models, and widening health technology assessment (HTA) mandates are fueling demand for faster, more defensible evidence packages. Generative AI cuts literature-review cycle times by 60%, reshaping project economics and enabling early payer engagement. Multinational pharmaceutical pipelines, especially in obesity, oncology, and gene therapy, generate sustained needs for sophisticated cost-effectiveness modeling. Service providers deploy large language models on federated real-world data (RWD) networks to unlock multi-jurisdiction evidence without breaching privacy guardrails. Providers that combine therapeutic depth with AI-enabled workflow automation are widening their competitive moat as clients consolidate vendor panels for integrated clinical-to-economic evidence generation.
Payers increasingly require real-world effectiveness data to justify premium pricing and coverage terms. The FDA's 2024 guidance endorsing electronic health record and claims data for regulatory decision making firmly positions RWD as a primary evidence stream. The Centers for Medicare & Medicaid Services widened outcomes-based contract structures to 40% more therapeutic areas versus 2023, raising the stakes for manufacturers that lack mature RWE programs. Europe's HTA Regulation adds a second compliance layer by obliging multinational dossiers to include comparative effectiveness data across 27 member states. Collectively, these mandates shift budgets toward analytics platforms capable of transforming dispersed claims, registry, and device telemetry data into payer-ready economic narratives. Premium pricing commanded by specialized RWE boutiques highlights the urgency with which sponsors are closing evidence gaps ahead of post-launch price negotiations.
Global HTA bodies now evaluate therapies using broader societal value criteria, extending beyond traditional cost-per-QALY thresholds. The EU Joint Clinical Assessment in effect since January 2025 establishes a harmonized evidence dossier for oncology and ATMPs while allowing member-state price autonomy. Japan, South Korea, and China are strengthening HTA review depth, integrating budget impact and patient-reported outcomes. French National Authority for Health's 2025-2030 roadmap prioritizes AI screening tools to vet manufacturer submissions, signaling digital transformation inside the assessors themselves. In the United States, hospital systems enrolled in alternative payment models must demonstrate procedure-level cost-effectiveness, accelerating provider-led outcomes research purchases. Heightened methodological expectations push sponsors toward specialist consultants with credentialed pharmacoeconomists and multi-country data rights.
Industry surveys forecast a 35% global shortfall in qualified health economists by 2030 as demand outstrips academic pipeline output. Axtria alone plans to hire 1,000 data scientists in India to shore up modeling capacity. Wage premiums climb and project lead times lengthen, squeezing service-provider margins even as top-line demand accelerates. Specialized fields such as cell-therapy modeling suffer most because standard pharmacoeconomic curricula lag behind therapeutic innovation, forcing firms to retrain clinical statisticians on value-assessment frameworks.
Other drivers and restraints analyzed in the detailed report include:
For complete list of drivers and restraints, kindly check the Table Of Contents.
Real-World Data Analytics & Information Systems held 37.35% revenue share in 2025, reflecting sponsors' need for defensible economic evaluations grounded in routine-care evidence. Consultancies and CROs invest in scalable cloud architectures that query claims, registries, and wearables data in near real time, shortening evidence cycles and reducing manual abstraction labor. The segment benefits from regulators' explicit RWD endorsement, with FDA guidance accelerating purchase decisions among late-stage biotech developers. Competitive pressure spurs innovation: IQVIA rebadged its HTA Accelerator as Market Access Insights in 2024, bundling dossier automation with budget impact simulation . Looking ahead, automated platform adoption, regional data-access partnerships, and integration of payer adjudication feeds will keep the segment expanding faster than the overall health economics and outcomes research services market as sponsors double-down on post-launch real-world performance monitoring.
Market Access & Reimbursement is the fastest-growing service line with a 16.82% CAGR through 2031. Rising HTA rigor and divergent sub-national payer rules require continuous benefit re-assessment, especially for one-time therapies whose value unfolds over decades. Vendors are embedding policy trackers and scenario engines that flag threshold breaches for list-price renegotiations, helping clients pre-empt formulary delisting risks. Economic Modeling & Evaluation remains indispensable; sophisticated microsimulation and partitioned-survival models underpin nearly every HTA submission. Clinical Outcomes Research gains tailwinds from decentralized trial modalities that capture richer patient-reported outcomes. Collectively, these dynamics underscore how buyers are converging on integrated partners capable of spanning RWD ingestion, methodological design, and policy engagement within a single contract.
The Health Economics and Outcomes Research Services Report is Segmented by Service (Economic Modelling/Evaluation, Real-World Data Analytics & Information Systems, and More), Service Provider (Consultancies, and More), End User (Biotech & Pharma Companies, and More), and Geography (North America, Europe, Asia Pacific, Middle East & Africa, South America). The Market Forecasts are Provided in Terms of Value (USD).
North America captured 45.95% revenue in 2025, underpinned by sophisticated reimbursement schemes that demand robust economic evidence. The FDA's RWD framework validation propels analytic spending and cements the United States as the reference market for methodological standards. Canada's transformation of CADTH into the Canadian Drug Agency strengthens national HTA capacity and is expected to widen economic scrutiny of specialty drugs. Shortfalls in data-science talent and wage inflation could temper regional growth; nonetheless, mid-term expansion remains resilient because pipeline intensity translates directly into HEOR workload.
Asia Pacific posts the fastest 17.93% CAGR through 2031, driven by rising clinical-trial volume, drug-pricing reforms, and digital-health infrastructure upgrades. Japan's 2025 drug-price adjustments tie reimbursement to real-world utilization, spurring pharmaceutical demand for proactive budget-impact tracking. China's NMPA alignment with ICH guidelines increases global dossier commonality, yet provincial tendering rules still require province-level evidence cuts. India's RWD network pilots provide cost-effective data sources for multinationals seeking broader ethnic representation. Service providers are localizing staff and forging data-licensing ventures with hospital consortia to comply with data -localization statutes. Europe maintains substantial share owing to the newly operational Joint Clinical Assessment that standardizes clinical-effectiveness components of submissions across 27 member states. While dossier unification reduces duplication, national payers retain price-setting autonomy, compelling sponsors to run country-specific budget-impact analyses. The French National Authority for Health's AI evaluation program sets a precedent for algorithm-assisted appraisal, potentially accelerating review times for AI-ready dossiers. Middle East & Africa and South America display mixed trajectories. Saudi Arabia operationalized managed entry agreements, pulling in HEOR expertise to structure risk-sharing deals. Brazil's judiciary overrules negative HTA recommendations in most patient litigation cases, inserting uncertainty that forces extensive scenario modeling. Vendors that master heterogeneous evidence rules position themselves for outsized wins as payer systems mature.
Axtria, Inc.