
혈우병 시장의 규모는 2025년에 145억 6,000만 달러로 예상되며, 2030년에는 192억 5,000만 달러로 확대되어, CAGR 5.74%를 나타낼 것으로 예측됩니다.

진단 확대, 유리한 환급, 반감기 연장(EHL) 재조합 인자 및 단일 투여 유전자 치료와 같은 혁신적인 옵션의 상업화가 혈우병 시장 전망을 재형성하고 있습니다. 억제제 환자에 대한 비인자 약물의 보급, 제조업체 간의 경쟁 격화, 신생아 스크리닝 프로그램의 확대도 지속적인 수요에 기여하고 있습니다. 주요 위험은 유전자 치료의 내구성에 대한 의문, 지속적인 혈장 채취 부족, 지불자의 예산 제약입니다. 그러나 혁신적인 예방적 접근 방식으로 인한 장기적인 비용 오프셋이 지불자에게 인식되고 있기 때문에 전반적인 기세는 여전히 긍정적입니다.
혈우병 사례의 특정이 급증하고 있으며, 신흥국에서의 검사 능력의 지속적인 확대로 2025년에는 세계의 진단 인구는 약 110만명에 달할 전망입니다. 중국은 2008년에서 2018년 사이에 평균 진단 지연을 13.3년에서 0.4년으로 단축했으며 개선 속도를 보여주고 있습니다. CDC 감시에서는 혈우병 치료 센터를 통해 관리되는 환자의 사망률이 감소했습니다. 구조화된 케어 네트워크를 가진 국가에서는 현재 거의 정상적인 평균 수명이 얻어지고 있으며, 첨단 치료에 대한 꾸준한 수요가 강화되고 있습니다.
ALTUVIIIO는 주 1회 투여를 가능하게 하고, 표준 인자에 비해 주입 횟수를 반감시킵니다. 임상 데이터에서 사용자의 65%가 예방 중 출혈을 경험했으며 10년간의 독점권을 가진 유럽의 승인이 규제 당국의 신뢰성을 높이고 있습니다. EHL 요인은 콜드체인의 부담을 줄이고 관절의 결과를 개선하며 어드히어런스를 강화하는 한편 기존 제품에 필적하는 외과적 안전성을 유지합니다.
미국의 연간 치료비는 환자 1인당 213,874달러에서 869,940달러이며 예산을 압박하고 있습니다. 유전자 치료는 정가가 350만 달러 가까이 되어 심사가 엄격해지고 있습니다. 유럽에서는 혈장 공급 부족이 인플레이션 압력을 더욱 높이고 있으며, 중국 도시 지역의 환자는 가처분 소득의 30% 이상의 자기 부담이 필요하여 예방 요법의 보급을 제한하고 있습니다. 브라질의 연간 지출액은 환자 1인당 평균 450,831달러로, 2025년에는 전국적으로 51억 9,000만 달러에 달할 전망입니다.
혈우병 A는 남성 출생 5,000명 중 1명이라는 높은 유병률로 2024년 혈우병 시장 점유율의 75.12%를 차지했습니다. 혈우병 B는 인자 IX의 긴 반감기가 유전자 치료의 지속적인 효능을 지원하기 때문에 성장이 가속화되고 있습니다. 미충족 요구 산업에서는 두 아형에 걸친 미충족 요구에 대응하는 비인자 약물의 진보가 보완적이라고 보고 있습니다.
혈우병 A의 기세는 ALTUVIIIO와 같은 EHL 인자와 에미시주맙과 같은 비인자 분자에서 유래하며, 이들은 모두 어드히어런스와 출혈 조절을 개선합니다. 혈우병 B의 병행 돌파구는 확립된 요인 집중이 치료의 유연성을 유지하는 반면, 유전자 치료 성공 사례가 투자를 자극하는 균형 잡힌 파이프라인을 창출합니다. 혈우병 C 및 기타 희귀 인자인 VII 인자 결핍은 소규모이지만 임상적으로 중요한 부문이며, 일본에서 인자 VII 인자 결핍의 연구는 유전자 재조합 활성화 인자 VII 제제에 의한 효과적인 관리를 입증하여 45.7%의 우수한 지혈 효과와 33.6%의 효과적인 지혈 효과를 달성했습니다. 전반적으로 전통적인 치료법과 고급 치료법의 융합은 보다 광범위한 시장에서 역동적인 경쟁을 유지하고 있습니다.
대체 요법은 2024년 92억 3,000만 달러로 혈우병 시장 규모의 63.41%를 차지했습니다. 그러나 유전자 치료는 2030년까지 연평균 복합 성장률(CAGR)이 가장 높을 것으로 예상되며 젊은층에 어필하는 일회 주입에 의한 치유의 가능성에 뒷받침되고 있습니다. 비인자 예방제는 의사가 억제제 환자를 바이패스 약물에서 간편한 피하 요법으로 옮기면서 빠르게 확대됩니다.
대체 요법은 점적 빈도를 낮추는 EHL의 기술 혁신의 혜택을 받으며 유전자 치료가 확대되어도 점유율은 유지됩니다. 반대로, 지불자는 평생 비용의 상쇄를 중시하고 있으며, 유전자 치료는 연간 60만 달러를 초과하는 예방 약을 상쇄할 수 있습니다. 비인자 분자는 선택사항을 더욱 다양화하고 각 양식이 명확한 임상 요구를 충족시키는 멀티트랙 접근법을 강화합니다.
북미는 2024년 세계 매출의 47.59%를 차지하였으며, 146개의 연방정부 출자 치료 센터가 52,000명 이상의 혈우병 환자를 관리하고 있습니다. 견고한 환급의 틀에는 유전자 치료에 대한 메디케어의 적용이나 의약품 취득을 조성하는 340B 프로그램 등이 있습니다. CDC의 커뮤니티 카운트 레지스트리 데이터는 134,000명의 모범 사례 가이드라인에 반영되어 새로운 약물의 증거를 바탕으로 채택을 가속화하고 있습니다. CSL 베링은 자금이 있음에도 불구하고 HEMGENIX의 도입이 예상보다 늦어지고 있음을 지적하며, 고비용 치료제와 관련된 미묘한 의사 결정 경로를 보여줍니다.
아시아태평양은 가장 급속히 확대되고 있는 지역이며, 2025년부터 2030년의 CAGR은 6.88%로 예측되고 있습니다. 중국은 진단 지연을 0.4년으로 단축하고 환급 확대에 따라 연간 인자 소비량을 증가시켰습니다. 일본의 HIKOBOSHI 조사에 의하면 매월 인자 VIII의 복용량은 2005년부터 2019년 사이에 5배로 증가하였으며, 적극적인 예방 동향을 반영하고 있습니다. 그럼에도 불구하고 중국에서는 혈우병 A 환자의 3.2%만이 예방약에 접근할 수 있었으며 재정적인 격차가 돋보입니다. 각 지역의 워킹 그룹은 치료 기준을 조화시키기 위해 국가 등록 및 협력 관리 프로그램을 추진하고 있습니다.
유럽은 성숙한 인프라와 첨단 환급 제도를 누리고 있지만 혈장 부족에 직면하고 있습니다. 유럽권은 미국에서 혈장의 약 40%를 수입하고 있으며 공급을 안정시키기 위해 200만 명의 신규 기증자를 찾고 있습니다. 중동 및 아프리카와 남미는 현저한 접근 부족에 직면하고 있으며, 아프리카 사례의 8%만 진단을 받아 전문 직원의 부족이 계속되고 있습니다. 혈액 응고인자의 소비량은 치료 기준치를 크게 밑돌고 있기 때문에 수요가 유지되고 있고, 인프라와 환급이 개선되면, 이들 지역은 장래의 성장 기회가 됩니다.
The hemophilia market size was valued at USD 14.56 billion in 2025 and is forecast to advance to USD 19.25 billion by 2030, recording a 5.74% CAGR during the period.
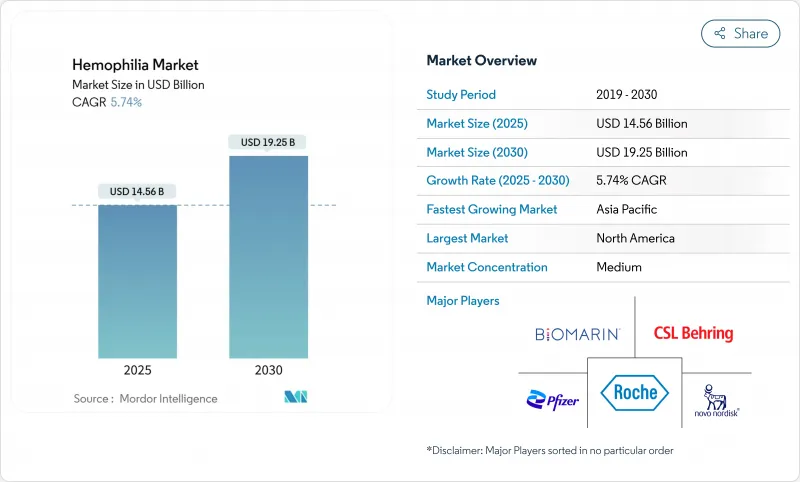
Expanding diagnosis, favorable reimbursement, and commercialization of transformative options such as extended half-life (EHL) recombinant factors and single-dose gene therapies are reshaping the hemophilia market landscape. Uptake of non-factor agents for inhibitor patients, intensifying competition among manufacturers, and broadening newborn-screening programs also contribute to sustainable demand. Headline risks stem from gene-therapy durability questions, persistent plasma-collection shortages, and payer budget constraints. Yet, overall momentum remains positive as payers increasingly recognize the long-run cost offsets offered by innovative prophylactic approaches.
Identification of hemophilia cases has risen sharply, taking the global diagnosed population to roughly 1.1 million in 2025 after sustained expansion of testing capacity in emerging economies. China reduced its average diagnosis lag from 13.3 years to 0.4 years between 2008 and 2018, illustrating the pace of improvement. Higher life expectancy is tied to broader prophylaxis adoption; CDC surveillance shows mortality declines in patients managed through hemophilia treatment centers. Countries with structured care networks now deliver near-normal life expectancy, reinforcing steady demand for advanced therapies.
ALTUVIIIO enables once-weekly dosing, reducing infusion counts by half compared with standard factors. Clinical data show 65% of users experience zero bleeds during prophylaxis, and European approval with 10-year exclusivity adds regulatory confidence. EHL factors cut cold-chain burdens, improve joint outcomes and bolster adherence, while maintaining surgical safety comparable to legacy products.
Annual US costs range from USD 213,874 to USD 869,940 per patient, straining budgets. Gene therapies intensify scrutiny with list prices near USD 3.5 million. Plasma-supply shortages add further inflationary pressure in Europe, while Chinese urban patients bear out-of-pocket costs topping 30% of disposable income, limiting prophylaxis uptake. Brazil's annual spend averages USD 450,831 per patient, totaling USD 5.19 billion nationally in 2025.
Other drivers and restraints analyzed in the detailed report include:
For complete list of drivers and restraints, kindly check the Table Of Contents.
Hemophilia A contributed 75.12% of hemophilia market share in 2024 due to its higher prevalence of roughly 1 in 5,000 male births. Hemophilia B is growing faster because factor IX's longer half-life supports durable gene-therapy efficacy; HEMGENIX enabled 94% of patients to stop prophylaxis over four years. The hemophilia industry sees complementary progress in non-factor agents that address unmet needs across both subtypes.
Momentum in hemophilia A derives from EHL factors such as ALTUVIIIO and non-factor molecules like emicizumab, which together improve adherence and bleed control. Parallel breakthroughs in hemophilia B create a balanced pipeline where gene-therapy success stories stimulate investment while established factor concentrates preserve treatment flexibility. Hemophilia C and other rare factor deficiencies represent a smaller but clinically significant segment, with factor VII deficiency studies in Japan demonstrating effective management with recombinant activated factor VII, achieving 45.7% excellent and 33.6% effective hemostatic responses. Overall, the convergence of traditional and advanced modalities maintains dynamic competition within the broader hemophilia market.
Replacement therapy retained 63.41% of the hemophilia market size in 2024, valued at USD 9.23 billion, reflecting its entrenched role in daily care. Yet gene therapy posts the highest CAGR to 2030, propelled by single-infusion curative potential that appeals to younger cohorts. Non-factor prophylactics expand quickly as physicians shift inhibitor patients from bypassing agents to convenient subcutaneous regimens.
Replacement therapy benefits from EHL innovations that lower infusion frequency, protecting share even as gene therapy scales. Conversely, payers weigh lifetime cost offsets-gene therapy could negate annual prophylaxis bills that surpass USD 600,000, creating strong incentives for adoption once durability comfort solidifies. Non-factor molecules further diversify choices, reinforcing a multitrack approach where each modality meets distinct clinical needs
The Hemophilia Market Report is Segmented by Disease Type (Hemophilia A, Hemophilia B, and More), Therapy (Replacement Therapy, Gene Therapy, and More), Product Type (Recombinant Coagulation Factor Concentrates and More), Treatment Setting (Prophylaxis and On-Demand), and Geography (North America, Europe, Asia-Pacific, Middle East and Africa, South America). The Market Forecasts are Provided in Terms of Value (USD).
North America accounted for 47.59% of global revenue in 2024, anchored by 146 federally funded hemophilia treatment centers that collectively manage more than 52,000 patients. Robust reimbursement frameworks include Medicare coverage for gene therapies and the 340B program that subsidizes drug acquisition. Data from the CDC's Community Counts registry informs best-practice guidelines across 134,000 individuals, accelerating evidence-based adoption of novel agents. Despite available funding, CSL Behring notes slower than anticipated uptake of HEMGENIX, illustrating the nuanced decision pathways that accompany high-cost curative therapies.
Asia-Pacific is the fastest-expanding region, projected at 6.88% CAGR from 2025-2030. China cut diagnosis delays to 0.4 years and increased annual factor consumption as reimbursement broadened. Japan's HIKOBOSHI study shows monthly factor VIII dosing climbed fivefold between 2005 and 2019, reflecting proactive prophylaxis trends. Nonetheless, only 3.2% of Chinese hemophilia A patients access prophylaxis, underscoring financial gaps. Regional working groups push for national registries and coordinated-care programs to harmonize treatment standards.
Europe enjoys mature infrastructure and progressive reimbursement but encounters plasma shortages; the bloc imports around 40% of plasma from the United States and seeks 2 million new donors to stabilize supply. Middle East & Africa and South America face pronounced access deficits; only 8% of African cases are diagnosed, and specialized staff shortages persist. Factor consumption remains well below therapeutic thresholds, sustaining unmet need and positioning these regions as future growth opportunities once infrastructure and reimbursement improve.