
수탁연구기관(CRO) 시장 규모는 2025년에 858억 8,000만 달러로 추정되고, 예측 기간(2025-2030년) CAGR 8.27%로 성장할 전망이며, 2030년에는 1,277억 7,000만 달러에 달할 것으로 예측됩니다.
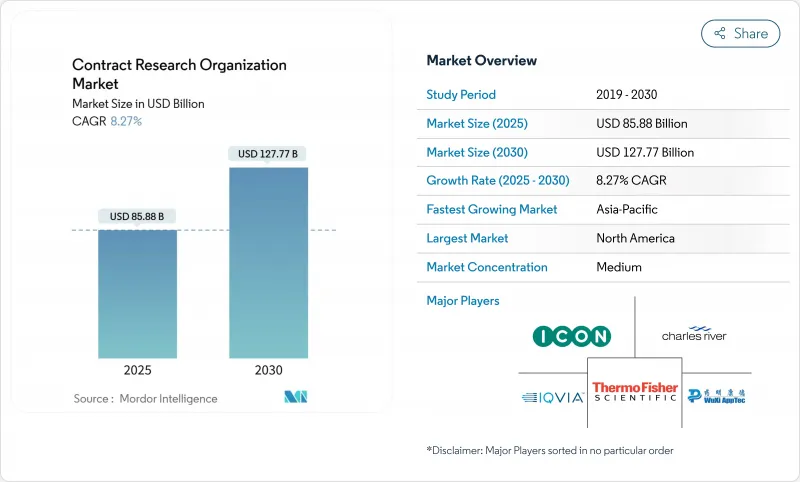
견고한 확장은 바이오 의약품의 연구개발 예산 증가, 자산 조명 운영 모델로의 이동, 후원자가 증가하는 개발 비용을 관리할 수 있는 유연한 아웃소싱 프레임워크에 대한 수요로 인한 것입니다. 종양 프로그램이 수익의 대부분을 차지하고 있는 한편, 각국 정부가 유행 대책에 자금을 제공하는 가운데, 감염증 연구가 가속하고 있습니다. 선도적인 스폰서는 디지털 테스트 플랫폼을 표준화하고 있으며, 소규모 바이오테크 기업은 틈새 CRO 능력에 의존하는 정밀의료 프로토콜을 추진하고 있습니다. 아시아태평양은 합리화된 규제와 낮은 운영 비용으로 세계 스폰서를 끌어들여 2자리 성장을 기록하고 있지만 수수료 수입에 대한 기여는 북미가 여전히 최대입니다. FSP(Functional Service Provider) 계약은 비용을 보다 명확하게 파악할 수 있기 때문에 대두되고 있지만, 복잡한 국제 공동 임상시험에서는 풀 서비스 계약이 필수적인 것에는 변함이 없습니다. 특히 임상연구 협회(CRA)의 인력 부족이 심각해지고 ICH E6(R3)과 관련된 데이터 관리 비용이 치솟기 때문에 당분간 영업 이익률이 저하될 수 있습니다.
거시경제의 역풍에도 불구하고 세계 바이오의약품 연구개발비는 2024년 2,880억 달러로 증가했습니다. 선도적인 의약품 제조업체는 특허 만료이 가까워짐에 따라 파이프라인 업데이트에 과거 최고의 예산을 돌리고 더 많은 이익률을 가진 자산을 찾고 외부 개발 파트너에 대한 의존도를 높이고 있습니다. CRO는 후원자가 초기 안전성 시험 및 후기 운영 물류를 오프로드함으로써 이익을 얻습니다. Precision Medicin 프로젝트는 첨단 바이오마커 전략을 필요로 하기 때문에 실험실과 데이터 사이언스 서비스를 통합한 공급자에 대한 수요가 높아집니다. 지속적인 투자 주기는 차별화된 서비스 라인의 가격 결정력을 지원하는 안정적인 장기 백로그를 시사합니다.
산업계가 스폰서가 된 임상시험 완료 건수는 2024년에는 전년 대비 10.7% 증가한 4,295건이었습니다. 종양학이 주도권을 유지하더라도 2023년에는 종양학에서 중국의 임상시험 점유율이 60%로 급증했습니다. 스폰서는 신속한 등록과 저렴한 비용으로 신흥 시장에 끌려가고 CRO는 아시아태평양의 사업 규모를 확대합니다. 시험 건수의 확대로 데이터 관리 플랫폼과 원격 모니터링 기술에 대한 수요가 높아져 시험 실시 시설의 성능이 향상됩니다. 다국어 프로젝트 팀을 동원하고 다양한 규제 체계에 대응할 수 있는 공급자는 타임라인의 위험 완화를 요구하는 세계 고객으로부터 지속적인 비즈니스를 획득하고 있습니다.
임상연구업계는 심각한 인재 위기에 직면하고 있으며, 암 연구센터의 95%가 임상시험의 질을 저하시키고 연구개발을 지연시키는 인재 부족 문제를 보고하고 있습니다. 미충족의 포지션은 인건비 예산을 부풀려, 시험 개시의 이정표를 늦춥니다. 일부 CRO는 가속 교육 아카데미와 사전 적격한 후보자 풀을 배포하여 온보딩 비용을 월 1만-5만 달러 절감하고 있습니다. 그러나 교육 커리큘럼이 임상연구 경력에 초점을 맞추기 쉽기 때문에 인력 부족은 계속되고 있습니다. 인력 부족은 정원 증가를 제한하고 의료 제공업체가 새로운 연구를 수락하는 속도를 제한할 수 있습니다.
보고서에서 분석된 기타 촉진요인 및 억제요인
2024년 수탁연구기관(CRO) 시장 규모는 임상연구 서비스가 총수입의 61.45%를 차지했으며, 후기 개발 전문 지식의 중요성이 확인되었습니다. 그러나 조기 단계 개발 매출은 2030년까지 연평균 복합 성장률(CAGR) 10.72%로 증가할 것으로 예상되며, 이는 서비스 범주 중 가장 빠릅니다. 스폰서는 1상 시험 전문가를 활용하여 인간에게 처음으로 투여한 안전성 데이터를 작성하여 자산 진행 위험을 줄입니다. 디지털 테스트 시뮬레이터와 적응형 프로토콜 설계는 사이클 시간을 단축하고 통합 바이오 분석 실험실은 조기 단계의 의사 결정을 지원하는 실시간 PK/PD 읽기를 제공합니다.
주요 CRO는 지난 5년간 250건 이상의 1상 시험을 완료했는데, 이는 미량 투여, 식효, 약물-약물 상호작용 평가에 대한 수요 증가를 반영합니다. 전임상 독성학에서 I상 임상시험으로의 원활한 전환을 제공하는 공급자는 증분 수익을 얻고 고객 유지를 강화합니다. Trial Pathfinder와 같은 AI 주도 도구는 전자 의료 기록 네트워크 내에서 자격을 갖춘 대상을 식별하고 등록 기간을 최대 30% 단축합니다. 이러한 효율화는 이 부문의 강력한 성장 궤도를 지원하고, 보다 광범위한 수탁연구기관(CRO) 시장에서 전략적 중요성을 강화하고 있습니다.
종양는 2024년에 수탁연구기관(CRO) 시장의 21.43%를 차지했으며, 1만 건을 넘는 활발한 조사에 지지되고 있습니다. Precision On Colology 프로토콜은 유전체 서열 결정, 동반진단, 시료 수집의 분산화 등을 필요로 하여 업무가 복잡해지고 있습니다. 종양학에 특화된 데이터 레이크와 분자 프로파일링 실험실을 갖춘 CRO는 체크 포인트 억제제와 차세대 CAR-T 요법을 진행하는 주요 제약 회사의 파이프라인에서 반복 프로젝트를 받았습니다.
감염증 임상 시험은 스폰서가 항균제 내성과 팬데믹 대책 자금에 대응하기 때문에 CAGR 10.81%를 보일 것으로 예측됩니다. BSL-3 실험실과 백신 시험 경험을 가진 공급자는 다국적 파트너십을 끌어들입니다. 중추 신경계와 심혈관계 시험은 한 자릿수 중반의 성장을 이루고 있으며, 유전자 치료 혁신에 견인된 희귀질환 포트폴리오는 희소 질병 지정 인센티브를 잘 이용할 수 있는 CRO에 고수익 기회를 제공합니다. 치료 믹스의 변화는 의료, 규제 및 업무 분야의 전문가를 하나의 거버넌스 모델로 통합하는 치료 영역 우수 프로그램에 대한 투자를 촉진합니다.
북미는 고가치 생물 제제의 풍부한 파이프라인과 FDA 지침의 합리화로 프로토콜 수정의 위험을 줄여 2024년 세계 매출의 38.92%를 차지했습니다. 첨단 시험 시설 인프라와 숙련된 시험 책임 의사는 높은 데이터 품질 점수로 이어져 풀 서비스 계약의 프리미엄 가격을 유지합니다. 그러나 비용 압력과 모집 문제로 인해 스폰서는 시험 시설 네트워크를 해외로 확대하는 경향이 있습니다.
아시아태평양의 CAGR은 11.26%로 세계에서 가장 빠른 성장이 전망됩니다. 중국과 한국의 규제 당국은 조기 승인 프레임 워크를 채택하여 시험 시작까지의 기간을 단축하고 있습니다. 종양학과 백신 연구에 대한 정부 보조금은 활동의 거점을 더욱 동쪽으로 기울이고 있습니다. 현지 언어에 익숙하고 세계 품질의 데이터 시스템을 갖춘 CRO는 여러 국가에서 위탁을 받았습니다. 유럽은 CTR536/2014에 기반한 하모나이제이션이 진행되는 가운데 완만한 성장을 유지하고 있지만, 일부 스폰서는 시작 시기의 장기화에 불만을 품고 있으며, 윤리심사위원회의 움직임이 빠른 중동 유럽에게 초기 단계의 일을 돌이키도록 촉구하고 있습니다.
남미는 다양한 환자 집단이 존재하는 비용 효율적인 선택이며, 약물감시 체제의 강화에 의해 세계의 스폰서의 신뢰가 향상되고 있습니다. 중동 및 아프리카는 아직 개발도상이지만 걸프 지역의 3차 의료기관이 확대됨에 따라 파일럿 종양학 및 희소질환 프로그램이 주목받고 있습니다. 전반적으로 지리적 다양화는 모집 위험을 줄이고 기존 지역이 용량과 비용 제약에 직면하더라도 수탁연구기관(CRO) 시장이 2자리 성장을 유지할 수 있도록 합니다.
The Contract Research Organization Market size is estimated at USD 85.88 billion in 2025, and is expected to reach USD 127.77 billion by 2030, at a CAGR of 8.27% during the forecast period (2025-2030).
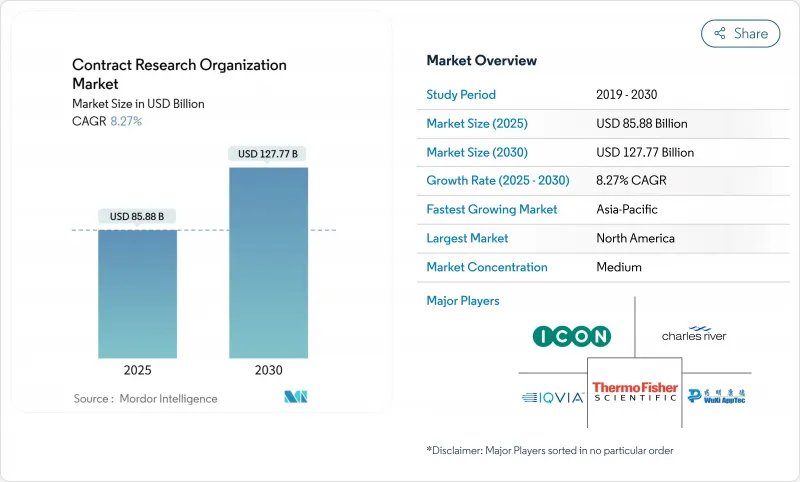
Robust expansion stems from rising biopharmaceutical R&D budgets, the shift toward asset-light operating models, and demand for flexible outsourcing frameworks that let sponsors manage growing development costs. Oncology programs dominate revenue, while infectious-disease studies accelerate as governments fund pandemic-readiness initiatives. Large sponsors are standardizing digital trial platforms, and small biotechs are pushing precision-medicine protocols that rely on niche CRO capabilities. Asia-Pacific is registering double-digit growth as streamlined regulations and lower operating costs attract global sponsors, though North America still delivers the largest contribution to fee revenue. Functional Service Provider (FSP) contracts are gaining ground because they offer clearer cost visibility, yet full-service engagements remain indispensable for complex global trials. Rising talent shortages, particularly among Clinical Research Associates (CRAs), and escalating data-governance costs linked to ICH E6(R3) could temper near-term operating margins.
Global biopharma R&D outlays rose to USD 288 billion in 2024, despite macroeconomic headwinds. Top drug makers channel record budgets toward pipeline renewal as patent expirations approach, and the hunt for higher-margin assets increases reliance on external development partners. CROs benefit as sponsors off-load early safety studies and late-phase operational logistics. Precision-medicine projects require sophisticated biomarker strategies, steering demand to providers with integrated laboratory and data-science services. The sustained investment cycle signals a stable long-term backlog that supports pricing power for differentiated service lines.
Completed industry-sponsored trials climbed 10.7% year over year to 4,295 in 2024. Oncology retained leadership, but China's share of cancer studies surged to 60% in 2023. Sponsors gravitate to emerging markets for faster enrollment and lower costs, prompting CROs to scale operations in Asia-Pacific. Expanded trial volume drives demand for data-management platforms and remote-monitoring technologies that improve site performance. Providers capable of mobilizing multilingual project teams and navigating diverse regulatory regimes attract recurring business from global clients looking to de-risk timelines.
The clinical research industry confronts an acute talent crisis, with 95% of cancer research centers reporting staffing issues that compromise trial quality and delay therapy development. Unfilled positions inflate labor budgets and delay site-initiation milestones. Some CROs deploy accelerated training academies and pre-qualified candidate pools that trim onboarding costs by USD 10,000-50,000 per month. Yet the talent gap persists because academic curricula rarely highlight clinical-research careers. Shortages limit capacity growth and may constrain the pace at which providers can accept new studies.
Other drivers and restraints analyzed in the detailed report include:
For complete list of drivers and restraints, kindly check the Table Of Contents.
The clinical research organization market size for Clinical Research Services stood at 61.45% of total revenue in 2024, confirming the importance of late-stage execution expertise. However, Early-Phase Development revenue is projected to rise at a 10.72% CAGR to 2030, the fastest among service categories. Sponsors lean on Phase I specialists to generate first-in-human safety data that de-risk asset progression. Digital trial simulators and adaptive protocol designs shorten cycle times, while integrated bioanalytical labs provide real-time PK/PD readouts that support early-stage decision making.
Leading CROs completed more than 250 Phase I studies during the past five years, reflecting heightened demand for micro-dosing, food-effect, and drug-drug interaction assessments. Providers offering seamless transition from preclinical toxicology to Phase I clinics capture incremental revenue and strengthen client retention. AI-driven tools such as Trial Pathfinder identify eligible subjects within electronic health-record networks, cutting enrollment timelines by up to 30%. These efficiencies underpin the segment's strong growth trajectory and reinforce its strategic importance within the broader clinical research organization market.
Oncology accounted for 21.43% of the clinical research organization market in 2024, underpinned by more than 10,000 active studies. Precision-oncology protocols require genomic sequencing, companion diagnostics, and decentralized specimen collection that elevate operational complexity. CROs with oncology-specific data lakes and molecular-profiling labs secure repeated projects from big-pharma pipelines advancing checkpoint inhibitors and next-generation CAR-T therapies.
Infectious-disease trials are forecast to register a 10.81% CAGR as sponsors respond to antimicrobial resistance and pandemic-preparedness funding. Providers with BSL-3 laboratories and vaccine-trial experience attract multinational partnerships. Central Nervous System and cardiovascular studies post mid-single-digit growth, while rare-disease portfolios driven by gene-therapy innovations offer high-margin opportunities for CROs that can navigate orphan-designation incentives. The shift in therapeutic mix encourages investment in therapeutic-area excellence programs that consolidate medical, regulatory, and operational subject-matter experts under one governance model.
The Contract Research Organization Market Report is Segmented by Service Type (Early-Phase Development Services, Clinical Research Services, and More), Therapeutic Area (Oncology, Infectious Diseases, and More), End User (Pharmaceutical and Biopharmaceutical Companies, and More), Delivery Model (Full-Service/Integrated CRO, and More) and Geography (North America, and More). The Market Forecasts are Provided in Terms of Value (USD).
North America contributed 38.92% of global revenue in 2024 thanks to its deep pipeline of high-value biologics and streamlined FDA guidance that de-risks protocol amendments. Advanced site infrastructures and seasoned investigators translate into high data-quality scores, sustaining premium pricing for full-service engagements. Yet cost pressures and recruitment challenges encourage sponsors to expand site networks overseas.
Asia-Pacific is set to record an 11.26% CAGR, the fastest in the world. Regulatory agencies in China and South Korea have adopted accelerated approval frameworks, cutting study-start timelines. Government grants for oncology and vaccine research further tilt the locus of activity eastward. CROs that couple local language proficiency with global-quality data systems capture multicountry mandates. Europe maintains modest growth amid ongoing harmonization under CTR 536/2014, but some sponsors complain of longer start-up deadlines, prompting them to divert early-phase work to Central-Eastern Europe where ethics review boards move faster.
South America presents a cost-effective alternative with diverse patient populations; strengthened pharmacovigilance systems are improving confidence among global sponsors. Middle East & Africa remain nascent but are drawing pilot oncology and rare-disease programs as tertiary centers in the Gulf expand. Overall, geographic diversification mitigates recruitment risk and ensures the clinical research organization market sustains double-digit growth even as established regions face capacity and cost constraints.