
오가노이드 시장은 2025년 12억 달러에서 2026년 14억 2,000만 달러로 성장할 것으로 예측되고, 2026-2031년에 걸쳐 CAGR 18.31%로 성장을 지속하여 2031년까지 32억 9,000만 달러에 달할 전망입니다.

이 견조한 성장은 세 가지 요인에 기반합니다. 즉, 동물 실험을 단계적으로 폐지하는 규제 의무화, 빠르게 성숙하는 3차원 바이오 프린팅, 그리고 인간 관련 질환 모델로의 제약 산업 전환입니다. 스탠퍼드에서 제작된 혈관화된 심장 및 간 오가노이드는 하류 제조를 제한하던 크기 장벽을 제거했으며, 매트릭스 없는 프로토콜은 오랜 기간 지속된 세포외 하이드로겔의 비용 부담을 완화하고 있습니다. 상업적 수요는 높은 실패율을 줄이기 위해 환자 유래 종양 오가노이드에 의존하는 종양학 프로그램과, 3D 인간 모델 채택을 가속화하는 동물 실험 승인 감소로 더욱 강화됩니다. 계약 연구 기관(CRO)들은 턴키 오가노이드 서비스를 확대하며, 소규모 바이오테크 기업들이 복잡한 배양 워크플로우를 아웃소싱함에 따라 오가노이드 시장에 추가적인 추진력을 제공하고 있습니다.
제약기업은 암치료제 개발에 있어서 기존의 90%라는 실패율을 억제하기 위해 제약사들은 종양학 자산의 역사적 90% 실패율을 억제하기 위해 환자 유래 종양 오가노이드를 초기 발견 단계에 도입하고 있습니다. 오가노이드는 종양 이질성을 보존하여 비용이 많이 드는 임상 시험 전에 실제 환자 생물학에 대한 다중 약물 조합 스크리닝을 가능하게 합니다. 이 접근법은 내성 메커니즘에 대한 실시간 통찰력을 제공하고 적응형 투여 전략을 수립하는 데 기여합니다. 신시내티 어린이 병원의 다중 영역 간 오가노이드는 설치류 생존율을 향상시켰으며, 오가노이드의 복잡성이 정적 질환 모델링을 넘어 기능적 조직 대체로 확장되고 있음을 보여줍니다. 대형 제약사 간의 경쟁적 긴박성은 전용 오가노이드 연구소 설립, 특허 출원, 3차원 종양 플랫폼에 집중되는 벤처 자금으로 드러난다.
오가노이드 기반 임상시험은 치료를 인구 평균에서 진정한 맞춤형 요법으로 전환시키고 있습니다. 췌장암 연구에서 반응 예측에 83.3%의 민감도와 92.9%의 특이도를 달성하여 임상적 관련성을 입증했습니다. 희귀질환 중심 임상시험은 제한된 환자 샘플로 체외에서 병리를 모델링하며 모집 난관을 극복하기 위해 오가노이드를 활용합니다. iScience는 최초의 인간 염증성 장질환 이식 임상시험을 보도하며 재생 오가노이드 치료의 임상 진입을 알렸다(01343-9). 규제 당국은 오가노이드 기반 동반진단 가이드라인을 마련 중이며, 예측 검사와 표적 치료제를 연계하는 미래 제품의 길을 열어주고 있습니다.
Matrigel과 같은 동물 유래 매트릭스는 mL당 200-500달러로 배양 비용의 최대 60%를 차지하여 자금력이 풍부한 연구실 외에서는 광범위한 채택을 저해합니다. 배치 간 변동성은 비용이 많이 드는 검증 주기를 유발하여 예산을 더욱 부풀립니다. 시장에 진입 중인 합성 또는 공학화된 하이드로겔은 가격 안정성과 우수한 배치 간 일관성을 약속합니다. 저접착성 플라스틱과 제어된 교반을 활용한 매트릭스 프리 프로토콜에 대한 병행 연구는 ECM 투입을 완전히 제거할 수 있으나, 이러한 전략은 새로운 표준 운영 절차와 광범위한 세포주 재검증을 요구합니다.
줄기세포 유래 시스템은 2025년 오가노이드 시장 점유율의 62.94%를 차지하며 표준화된 스크리닝 요구사항에 적합함을 입증했습니다. 이 세분화는 생산 과정 전반에 걸쳐 안정적으로 분화하는 특성이 잘 규명된 유도만능줄기세포(iPSC)의 이점을 활용하여 배치 간 변동성을 줄이고 규제 심사를 용이하게 합니다. 줄기세포 기반 오가노이드 시장은 예측 가능한 확장률과 명확한 지적 재산권 경로 덕분에 현재 매출에서 가장 큰 비중을 차지합니다. 종양 유래 오가노이드는 기반은 작지만, 종양학 센터에서 치료 계층화를 위한 환자 맞춤형 아바타를 요구함에 따라 19.18%의 연평균 성장률(CAGR)로 증가하고 있습니다.
iPSC 재프로그래밍, 마이크로플루이딕스 순환, 다중 세포 공동 배양 기술의 교차점은 줄기세포 및 종양 시스템의 생리학적 깊이를 확장하고 있습니다. 데이터 공유 컨소시엄은 각 계통과 연계된 유전체 및 약리학적 지문을 아카이빙하기 시작하여 기관 간 메타분석을 가능하게 했습니다. 그럼에도 종양 유래 모델은 줄기세포 수준의 신뢰도를 달성하기 전에 생존율과 배양 수명의 이질성을 극복해야 합니다.
신약 개발 및 스크리닝은 2025년 오가노이드 시장 규모의 41.42%를 차지하며, 대형 제약사의 약물 탈락률 저감 및 독성 위험 조기 발견에 대한 긴급한 요구를 반영합니다. 고내용 스크리닝과 소형화 다중웰 바이오리액터의 통합으로 실험당 수만 개의 오가노이드 생산이 가능해져 화합물 라이브러리 규모에 근접하고 있습니다. 그러나 정밀의학 및 맞춤형 의학 분야가 19.84%의 연평균 복합 성장률(CAGR)로 가장 높은 성장 궤적을 보입니다. 특히 대장암 및 췌장암 치료에서 오가노이드 기반 치료 결정에 대한 규제 기관의 인정이 이 활용 사례를 신속한 보험 적용 경로로 이끌고 있습니다.
오가노이드 영상 및 단일 세포 전사체 분석을 해석하는 인공지능 파이프라인은 유망물질 식별을 가속화하고, 인적 오류를 줄이며, 직관적이지 않은 바이오마커를 발견합니다. 독성학 및 질병 모델링 응용 분야가 그 뒤를 바짝 따르며, 특히 오가노이드가 설치류 연구에서는 재현되지 않는 장기 특이적 대사를 모방하는 경우에 그러합니다. 재생의학은 여전히 신흥 분야이지만, 간 및 갑상선 전임상 이식의 성공은 그 변혁적 잠재력을 입증합니다.
북미는 비동물 모델 가속화를 위한 FDA 로드맵과 CuSTOM, 스탠퍼드 등 허브에 대한 국립보건원(NIH)의 풍부한 자금 지원에 힘입어 2025년 매출의 43.88%를 차지하며 시장을 선도했습니다. 써모 피셔 사이언티픽(Thermo Fisher Scientific)과 같은 미국 대기업들은 오가노이드 워크플로우와 연계되는 고순도 여과 자산 인수를 위해 41억 달러를 투자하며 생태계를 강화했습니다. 다중 구역 간에서 혈관화된 심장 조직에 이르는 학술적 돌파구는 기술 이전 사무소를 통해 상업적 파이프라인으로 직접 연결됩니다.
유럽은 네덜란드, 독일, 영국에 클러스터를 가진 견고한 학술 기반을 가지고 있습니다. Merck KGaA의 HUB Organoids의 인수는 선진 생물학 포트폴리오 확대를 목표로 한 전략적 통합의 좋은 예입니다. 정책 입안자는 동물 사용에 반대하는 여론과 보조를 맞추어 3차원 인간 모델을 우선하는 조성 제도를 추진하고 있습니다. 가맹국 간의 경제 격차로 도입률은 변동을 보이지만, 혁신적 의약품 이니셔티브(IMI) 등 EU 횡단적 노력이 기준과 자금 흐름의 조화에 공헌하고 있습니다.
아시아태평양 지역은 2031년까지 연평균 21.38% 성장률로 가장 빠르게 성장하는 지역입니다. 중국의 5개년 계획은 재생의학을 최우선 과제로 삼아, 합작 투자 및 지식재산권 공유 협정을 통해 서구 제약사와 공동 개발하는 대학 및 스타트업에 보조금을 집중 지원합니다. 일본은 세포 기반 치료제에 대한 성숙한 규제 경로를 제공하여 조기 인체 시험을 가능하게 합니다. 한국, 호주, 인도는 계약 제조 자원을 확대 중이며, 이로 인해 해당 지역은 비용 효율적인 파일럿 생산을 위한 매력적인 장소가 되고 있습니다. 환율 변동과 인력 양성 격차가 위험 요인으로 작용하지만, 정부 인센티브와 증가하는 임상 시험 규모가 장기적 확장을 뒷받침합니다.
The organoids market is expected to grow from USD 1.20 billion in 2025 to USD 1.42 billion in 2026 and is forecast to reach USD 3.29 billion by 2031 at 18.31% CAGR over 2026-2031.
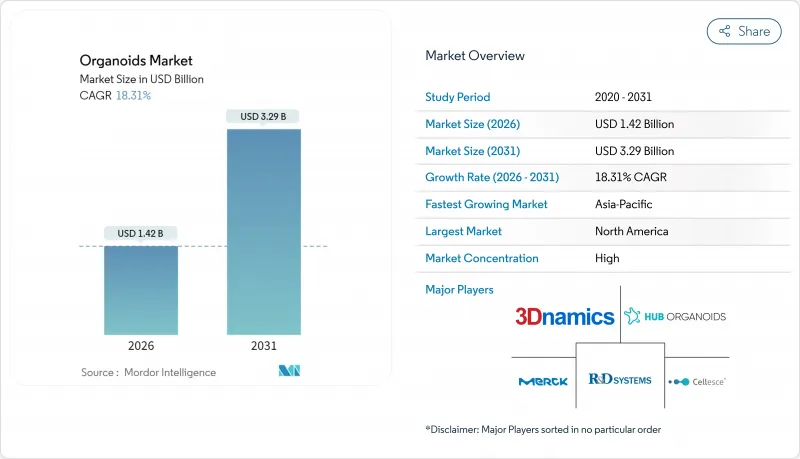
The strong upside rests on three converging forces: regulatory mandates that phase out animal testing, fast-maturing 3-D bioprinting, and the pharmaceutical shift to human-relevant disease models. Vascularized heart and liver organoids created at Stanford remove the size barriers that once limited downstream manufacturing, while matrix-free protocols are easing the long-standing cost burden of extracellular hydrogels. Commercial demand is reinforced by oncology programs that now rely on patient-derived tumor organoids to trim high attrition rates, and by the broader decline in animal-testing approvals that accelerates 3-D human model uptake. Contract research organizations (CROs) are scaling turnkey organoid services, putting additional momentum behind the organoids market as smaller biotechs outsource complex culture workflows.
Pharmaceutical teams are embedding patient-derived tumor organoids into early discovery to curb the historical 90% failure rate of oncology assets. Organoids conserve tumor heterogeneity, enabling multiple drug combinations to be screened against authentic patient biology before costly clinical trials. The approach supplies real-time insight into resistance mechanisms and informs adaptive dosing strategies. Cincinnati Children's multi-zonal liver organoids, which improved rodent survival, illustrate how organoid complexity now extends beyond static disease modeling toward functional tissue replacement. Competitive urgency among big pharma is reflected in dedicated organoid units, IP filings, and venture funding channelled to 3-D tumor platforms.
Organoid-guided trials are shifting care from population averages to truly individualized regimens. A pancreatic cancer study achieved 83.3% sensitivity and 92.9% specificity in predicting responses, underscoring clinical relevance. Trials focused on rare diseases leverage organoids to overcome recruitment hurdles, modeling pathologies in vitro with only limited patient samples. iScience reported the first human inflammatory bowel disease transplant trial, marking clinical entry for regenerative organoid therapy (01343-9). Regulators are drafting guidance for organoid-based companion diagnostics, clearing a path for future products that link predictive assays with targeted therapeutics.
Animal-derived matrices such as Matrigel cost USD 200-500 per mL and account for up to 60% of culture spend, discouraging widespread adoption outside well-funded labs. Batch variability triggers expensive validation cycles that further inflate budgets. Synthetic or engineered hydrogels now entering the market promise price stability and better lot-to-lot consistency. Parallel research on matrix-free protocols-leveraging low-adhesion plastics and controlled agitation-could eliminate ECM inputs altogether, but these strategies require fresh standard-operating procedures and extensive cell-line requalification.
Other drivers and restraints analyzed in the detailed report include:
For complete list of drivers and restraints, kindly check the Table Of Contents.
Stem-cell-derived systems captured 62.94% of organoids market share in 2025, underscoring their suitability for standardized screening requirements. The segment benefits from well-characterized induced pluripotent stem cells that differentiate reliably across production runs, reducing batch variance and easing regulatory audits. The stem-cell-driven organoids market contributes the largest slice of current revenue owing to predictable expansion rates and clear intellectual-property paths. Tumor-derived organoids, while holding a smaller base, are rising at a 19.18% CAGR as oncology centers demand patient-specific avatars for treatment stratification.
The technological intersection of iPSC reprogramming, microfluidic perfusion, and multi-cell co-culture is expanding the physiological depth of both stems and tumor systems. Data sharing consortia have started to archive genomic and pharmacological fingerprints linked to each line, enabling meta-analysis across institutions. Nevertheless, tumor-derived models must still overcome heterogeneity in take rates and culture lifespans before matching stem-cell reliability.
Drug discovery and screening amassed 41.42% of the 2025 organoids market size, reflecting big pharma's urgent need to lower attrition and spot toxic liabilities earlier. Integration of high-content screening with miniaturized multi-well bioreactors now yields tens of thousands of organoids per experiment, approaching compound-library scale. Precision and personalized medicine, however, exhibits the highest trajectory with a 19.84% CAGR. Regulatory recognition of organoid-guided therapy decisions, especially in colorectal and pancreatic cancers, positions this use-case for fast-track reimbursement pathways.
Artificial-intelligence pipelines that parse organoid imaging and single-cell transcriptomics accelerate hit identification, reduce human error, and uncover non-intuitive biomarkers. Toxicology and disease-modeling applications follow closely, especially where organoids replicate organ-specific metabolism absent in rodent studies. Regenerative medicine remains an emerging frontier, yet the successful liver and thyroid preclinical implants underscore its transformative potential.
The Organoids Market Report is Segmented by Type (Stem-Cell-Derived Organoids, Tumor-Derived Organoids), Application (Drug Discovery & Screening, Disease & Toxicology Modelling, and More), End User (Pharmaceutical & Biotech Companies, Academic & Research Institutes, and More), Technology (Scaffold-Based 3-D Culture, and More), and Geography (North America, and More). The Market Forecasts are Provided in Terms of Value (USD).
North America opened 2025 with 43.88% revenue, buoyed by the FDA roadmap that accelerates non-animal models and by generous National Institutes of Health funding for CuSTOM, Stanford, and other hubs. U.S. conglomerates such as Thermo Fisher Scientific reinforced the ecosystem by allocating USD 4.1 billion to acquire high-purity filtration assets that dovetail with organoid workflows. Academic breakthroughs-from multi-zonal liver to vascularized cardiac tissue-feed directly into commercial pipelines through technology-transfer offices.
Europe sits on a solid academic backbone with clusters in the Netherlands, Germany, and the United Kingdom. Merck KGaA's purchase of HUB Organoids exemplifies strategic consolidation aimed at expanding advanced-biology portfolios. Policymakers align with public sentiment against animal use, driving grant schemes that prioritize 3-D human models. Economic diversity across member states causes uneven adoption rates, but pan-EU initiatives-such as the Innovative Medicines Initiative-help harmonize standards and funding streams.
Asia-Pacific is the fastest-growing territory at 21.38% CAGR to 2031. China's Five-Year Plan prioritizes regenerative medicine, funneling grants to universities and startups that co-develop with Western pharma through joint ventures and IP-sharing arrangements. Japan offers a mature regulatory path for cell-based therapies, enabling earlier human trials. South Korea, Australia, and India are scaling contract manufacturing resources, making the region an attractive site for cost-effective pilot production. While currency fluctuations and training gaps pose risks, government incentives and rising clinical-trial volume underpin long-term expansion.