
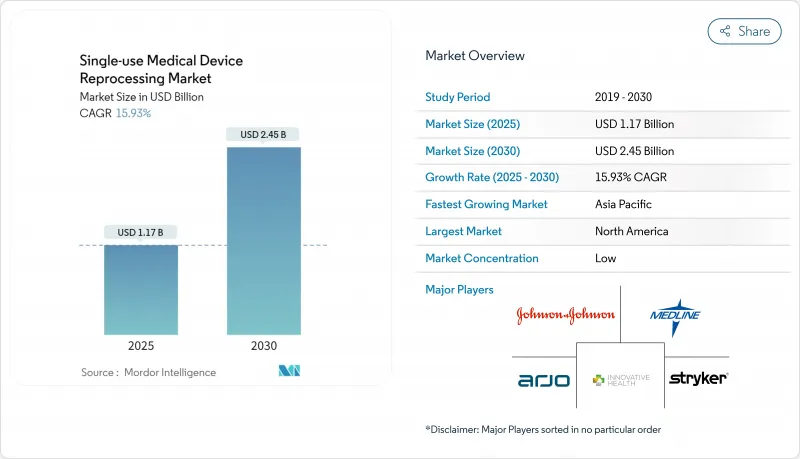
일회용 의료기기 재처리 시장은 2025년에는 11억 7,000만 달러로 평가되었고, 2030년에는 CAGR 15.93%로 성장할 전망이며, 24억 5,000만 달러로 확대될 것으로 예측되어, 세계 헬스케어 시스템에서 비용 억제 및 지속가능성의 실증된 솔루션에 대한 왕성한 수요를 뒷받침하고 있습니다.

미국 FDA의 재제조에 관한 2024년 5월 지침에 의한 규제의 명확화와 기화 과산화수소 멸균 수용 확대로 컴플라이언스의 불확실성이 감소하고 재처리가 안전하다고 생각되는 기기의 범위가 넓어지고 있습니다. 특히 2024년 17개국에서 4억 5,100만 달러의 비용 절감이 문서화된 후, 병원 조달팀은 재처리를 인플레이션과 상환의 역풍 속에서 금리를 확보하기 위한 품목의 테코로 보고 있습니다. 지속가능성의 의무화, Scope-3 탄소 회계, 제한적인 OEM 계약에 대한 독점 금지법의 시행은 디바이스 레벨 채용을 가속화하고 있으며, AI 대응 추적성 플랫폼과 자동 멸균기는 환자 안전 신뢰를 강화하고 있습니다.
축소되는 영업 이익률로 인해 병원 공급망의 재처리가 옵션에서 필수로 전환되었으며, 대부분의 경우 OEM 정가를 기준으로 40-60%의 장비 수준을 절약할 수 있습니다. 메디케어 결제 개혁과 민간 결제 계약은 일회용 장비에 대한 지출의 가시성을 높이고 퇴역 군인 보건국은 2025년에 자신의 재처리 제한을 재검토하도록 촉구했습니다. 최고재무책임자(CFO)는 연간 자본배분 모델에 재프로세싱의 ROI를 점점 더 통합하여 여러 병원 네트워크에서 조직적으로 채용되고 있습니다. 비영리 의료 시스템의 유동성을 평가하는 채권등급 기관에 있어서, 저축의 규모는 지금 중요하며, 경영진의 헌신을 강화하고 있습니다. 인플레이션이 계속되는 가운데 2027년까지 신규 계좌 전환의 3분의 1은 재무 스튜어드십이 지원할 것으로 예측됩니다.
FDA의 2024년 재제조 지침은 서비싱과 재처리의 경계를 명확히 하여 제3자 사업자의 법적 모호성을 줄였습니다. 기화된 과산화수소가 확립된 멸균 방법으로 인정되었으며, 에틸렌 옥사이드 이외의 유효한 방법이 다양화되었습니다. 일본은 일회용 기기의 재제조를, 2024년까지 준수 기한을 어긋나 QMS 조례에 임베디드해, 다른 APAC 규제 당국의 모델이 되었습니다. FDA가 2025년에 재사용할 수 있는 컴포넌트를 포함하는 VARIPULSE와 Sphere-9 카테터 시스템을 승인한 것은 혼합 사용 플랫폼에 대한 신뢰가 높아졌습니다. 이러한 획기적인 사건으로 일회용 의료기기 재처리 시장의 대응가능한 밑단은 심장병학뿐만 아니라 복잡한 전기생리학 분야로도 확대되었습니다.
존슨 엔드 존슨의 2025년 반 트러스트 법 위반으로 인한 손실은 4억 4,200만 달러의 위약금을 수반하며, 재처리 채용에 대한 OEM의 조직적 저항을 부각시켰습니다. 제조업체는 '일회용' 라벨을 활용하고, 특히 규제 감시가 시작된지 얼마 안된 신흥 시장에서 법적 불확실성을 계속 뿌려 놓고 있습니다. OEM으로부터 자금을 받고 있는 업계 단체는 장비의 적격성 리스트의 확대에 반대하는 로비 활동을 실시해, 복강경 기기와 같은 대량 생산되는 카테고리에서의 임상 도입을 늦추고 있습니다. 독점금지법의 감시에 의해 엄청난 계약 제한이 억제되더라도, 스탭 트레이닝의 중단이라고 하는 소프트면의 장벽은 여전히 의료 제공업체의 신뢰를 방해할 가능성이 있습니다. 이러한 법적 환경은 가까운 미래의 CAGR 예측치를 3% 포인트 가까이 밀어 내릴 것으로 예측됩니다.
심장혈관 카테터는 임상적 동등성 시험과 표준화된 멸균 워크플로우를 지원하여 2024년 일회용 의료기기 재처리 시장 규모의 37.56%를 차지했습니다. 전기 생리학 카테터는 재사용 가능한 구성요소를 통합한 VARIPULSE 및 Sphere-9 시스템의 FDA 승인이 몰락하고 CAGR 16.09%로 이 분야를 선도하고 있습니다. 복강경 수술 기구는 로봇 수술의 규모로부터 혜택을 받지만, 복잡한 형상으로 인해 자동 세척 터널이 필요하며 주로 주요 상업 재처리 업체에서 사용되고 있습니다. 소화기 수술 기구의 성장은 과거 감염 위험을 줄이는 ULTRA GI 과산화수소 가스 플라즈마 사이클과 같은 멸균 돌파구에 달려 있습니다. 정형외과용 체외고정기구는 환자의 취향에 맞는 구성과 장착시간의 길이로 인해 여전히 틈새가 되는 반면, 일반외과용 기구는 안정적인 판매량을 제공하는 반면, 가격의 상품화 압력에 직면하고 있습니다.
기술의 진보, 특히 AI를 이용한 장비 추적 태그와 클라우드 분석은 재사용 사이클 전반에 걸쳐 제품 수준의 성능 벤치마크를 가능하게 하고, 재가공된 대체품에 대한 외과 의사의 신뢰를 높여주고 있습니다. 강화된 검사 광학 시스템과 비파괴 무결성 검사는 품질 보증을 지속적으로 향상시키며, 심장혈관 및 복강경 장비의 고장률이 새로운 OEM 장치와 거의 동등하게 유지하는 데 도움이 됩니다. 카테고리의 수명 주기 배출량이 공식 ESG 스코어카드에 들어가면서, 공급자는 카테터와 같은 대량의 일회용 카테고리를 우선적으로 조기 전환을 도모하고 일회용 의료기기 재처리 시장에서 순환기 하위 부문의 리더십을 강화하고 있습니다.
2024년 일회용 의료기기 재처리 시장 점유율의 84.45%는 타사로 제작되었으며, 멸균, 검증 및 물류의 규모 이점을 반영합니다. 이 분야는 2030년까지 CAGR 16.37%로 성장할 전망이며, 이는 자원이 부족한 원내 시설보다 ISO 인정을 받은 전문 시설을 선호하는 지불자나 규제 당국의 의향에 의한 것입니다. 메드라인이 2024년에 에코랩의 수술 솔루션 사업을 인수하고 재처리를 공급자의 조달을 단순화하는 풀라인 유통 모델로 통합한 것으로 대표되는 것처럼 통합은 계속되고 있습니다.
내부 프로그램을 평가하는 병원은 멸균기, 추적성 소프트웨어, 품질 검사를 위한 자본 지출에 직면하고 있으며, 이 금액은 시설당 500만 달러를 초과하고 비용 이익 계산이 아웃소싱에 기여하고 있습니다. 2026년 FDA QSR과 ISO 13485를 조화시키는 규제 개정이 이루어지며 문서화 부담이 증가할 것으로 예상되며 전문 규제 팀이 없는 소규모 원내 시설은 불리해집니다. 상업 파트너가 AI 화상 검사나 로봇 포장 라인을 채용함에 따라 처리 효율은 5-8포인트의 마진 우위성을 만들어 병원 경영과의 격차가 넓어집니다. 따라서 미국 상위 100개 IDN의 대부분은 현재 하이브리드 모델을 운영하고 있으며, 소량의 장비만을 현장에 남겨두고, 대량의 카테터 실험실과 EP 장비는 매주 타사 공장에 출하하고 있습니다.
북미는 2024년 매출액의 43.53%를 차지했으며, FDA 지침의 확실성, 독점금지법 시행, 정비된 제3자 네트워크에 지지되고 있습니다. 미국 시장은 재처리를 ESG 주요 성과 평가 지표와 일치시키는 병원의 지속가능성 헌장으로부터도 혜택을 누리고 있습니다. 캐나다의 공공 의료 제도는 예산의 상한을 상쇄하기 위해 재처리를 채택하고, 멕시코 바하 캘리포니아의 의료기기 클러스터는 국경을 넘어 공급자에게 근해 멸균 능력 확장을 제공합니다.
아시아태평양은 일본 QMS 규칙의 조화와 2028년까지 1급 도시에서의 기기 재이용 인증의 70%를 목표로 하는 중국의 병원 근대화 프로그램에 견인되어 2030년까지 17.25%의 연평균 복합 성장률(CAGR)을 나타낼 전망입니다. 인도의 아유슈만 발라트 제도는 보험 적용을 확대하고 공립병원은 고정 예산의 신장을 강요받기 때문에 2026년부터 조달 입찰로 재처리가 증가합니다. 한국과 호주는 일찍부터 전자빔 살균을 채택해 왔지만, 2035년까지 폐기물 제로의 국가 목표를 달성하기 위해 AI 추적 카테터 재사용을 시험적으로 도입합니다.
유럽 전망은 가맹국 간에 다른 재처리 규칙을 도입하고 국경을 넘은 사업자의 컴플라이언스 비용을 최대 25% 상승시키는 제17조의 분단화에 의해 완화되고 있습니다. 독일의 CE 재처리 금지 가능성은 2026년에 시행될 경우 연간 9,000만 달러의 수입을 잃을 수 있지만, 덴마크와 네덜란드는 엄격한 품질 관리 모니터링 하에서 재처리를 가능하게 하는 지침을 발표했습니다. 영국은 EU의 틀에서 벗어나 2045년까지 회피 가능한 일회용 의료품을 없애는 것을 정식으로 목표로 하고 있으며 재처리를 중심적인 컴플라이언스 메커니즘으로 자리매김하고 있습니다. 프랑스 보건부는 2024년에 십이지장경 재처리의 경제성을 평가하기 위한 제한적인 시험 운영을 시작하여 2027년 국가 정책에 반영할 수 있습니다.
The single-use medical device reprocessing market is valued at USD 1.17 billion in 2025 and is forecast to expand to USD 2.45 billion in 2030 at a 15.93% CAGR, underscoring robust demand for proven cost-containment and sustainability solutions in global healthcare systems .
Regulatory clarity from the U.S. FDA's May 2024 guidance on remanufacturing and growing acceptance of vaporized hydrogen peroxide sterilization have reduced compliance uncertainty and broadened the universe of devices considered safe for reprocessing. Hospital procurement teams view reprocessing as a line-item lever for margin preservation amid inflation and reimbursement headwinds, especially after documented savings of USD 451 million in 2024 across 17 countries. Sustainability mandates, Scope-3 carbon accounting and antitrust enforcement against restrictive OEM contracts are accelerating device-level adoption, while AI-enabled traceability platforms and automated sterilizers reinforce patient-safety confidence .
Shrinking operating margins have moved reprocessing from optional to essential in hospital supply-chain playbooks, often delivering 40-60% device-level savings versus OEM list prices . Medicare payment reforms and private-payer contracting heightened visibility of disposable device spend, prompting the Veterans Health Administration to revisit its own reprocessing restrictions in 2025 . Chief financial officers increasingly embed reprocessing ROIs in annual capital-allocation models, translating to systematic adoption across multi-hospital networks . The scale of savings is now material to bond-rating agencies evaluating nonprofit health-system liquidity, reinforcing management commitment . As inflation persists, financial stewardship is expected to underpin at least one-third of new account conversions through 2027 .
The FDA's 2024 remanufacturing guidance clarified boundaries between servicing and reprocessing, reducing legal ambiguity for third-party operators . Vaporized hydrogen peroxide earned recognition as an established sterilization modality, diversifying validated methods beyond ethylene oxide . Japan embedded single-use device re-manufacturing into its QMS ordinance with staggered compliance deadlines through 2024, setting a template for other APAC regulators . The FDA's 2025 approvals of VARIPULSE and Sphere-9 catheter systems, each containing reusable components, signaled growing confidence in mixed-use platforms . These milestones collectively expand the single-use medical device reprocessing market addressable base beyond cardiology into complex electrophysiology segments .
Johnson & Johnson's 2025 antitrust loss, accompanied by a USD 442 million penalty, underscores systemic OEM resistance to reprocessing adoption . Manufacturers continue to leverage "single-use" labels to sow legal uncertainty, particularly in emerging markets with nascent regulatory oversight . Trade associations funded by OEMs lobby against expanded device-eligibility lists, delaying clinical uptake in high-volume categories like laparoscopic instruments . Even where antitrust scrutiny curbs overt contract restrictions, soft barriers such as staff-training withdrawal can still impede provider confidence . The resulting legal environment is expected to shave nearly three percentage points off projected CAGR in the near term .
Other drivers and restraints analyzed in the detailed report include:
For complete list of drivers and restraints, kindly check the Table Of Contents.
The cardiovascular catheter category delivered 37.56% of single-use medical device reprocessing market size in 2024, sustained by well-documented clinical equivalency studies and standardized sterilization workflows . Electrophysiology catheters are pacing the field with a 16.09% CAGR, catalyzed by FDA approvals for VARIPULSE and Sphere-9 systems that incorporate reusable components . Laparoscopic instruments benefit from robotic-surgery scale, yet complex geometries demand automated cleaning tunnels available chiefly at large commercial reprocessors . Gastroenterology device growth hinges on sterilization breakthroughs like ULTRA GI hydrogen-peroxide gas-plasma cycles, which mitigate past infection risks . Orthopedic external-fixation hardware remains niche due to patient-custom configurations and extended wear times, while general-surgery tools provide steady volume but face pricing commoditization pressures .
Technological advances, notably AI-based device-tracking tags and cloud analytics, now allow product-level performance benchmarking across reuse cycles, fostering surgeon trust in reprocessed alternatives . Enhanced inspection optics and non-destructive integrity testing continue to elevate quality assurance, helping cardiovascular and laparoscopic devices maintain near-parity with new OEM units in failure rates . As category life-cycle emissions enter formal ESG scorecards, providers prioritize high-volume disposable categories such as catheters for earliest conversion, reinforcing leadership of cardiovascular subsegments in the single-use medical device reprocessing market .
Third-party operators accounted for 84.45% of single-use medical device reprocessing market share in 2024, reflecting scale advantages in sterilization, validation and logistics . The sector's 16.37% CAGR through 2030 is fueled by payer and regulator preference for ISO-certified specialist facilities over resource-strained in-house units . Consolidation continues, exemplified by Medline's 2024 acquisition of Ecolab's surgical solutions business, integrating reprocessing into a full-line distribution model that simplifies provider procurement.
Hospitals evaluating internal programs confront capital outlays for sterilizers, traceability software and quality testing that exceed USD 5 million per site, tipping cost-benefit calculations toward outsourcing . Regulatory amendments harmonizing FDA QSR with ISO 13485 in 2026 are expected to heighten documentation burdens, disadvantaging smaller in-house units lacking dedicated regulatory teams . As commercial partners adopt AI vision-inspection and robotic packing lines, throughput efficiencies generate 5-8-point margin advantages, widening the gap versus hospital-run operations. Accordingly, most top-100 U.S. IDNs now operate hybrid models where only very low-volume instruments remain on-site, while high-volume cath-lab and EP devices ship to third-party plants weekly.
The Single-Use Medical Device Reprocessing Market Report is Segmented by Product Type (Cardiovascular Catheters, Electrophysiology Catheters, and More), Service Provider (Third-party/Commercial Reprocessors, In-house/Hospital Reprocessing Units), Application (Cardiology, and More), End User (Hospitals & Surgical Centers, and More), and Geography (North America, and More). The Market Forecasts are Provided in Terms of Value (USD).
North America generated 43.53% of 2024 revenue, underpinned by FDA guidance certainty, antitrust enforcement and well-developed third-party networks . The U.S. market also benefits from hospital sustainability charters that align reprocessing with ESG key-performance indicators . Canada's public-funded health system adopts reprocessing to offset budget caps, while Mexico's medical-device cluster in Baja California offers near-shore sterilization capacity expansion for cross-border providers .
Asia-Pacific is on track to record a 17.25% CAGR to 2030, led by Japan's QMS rule harmonization and China's hospital-modernization programs, which target 70% device-reuse certification in tier-1 cities by 2028 . India's Ayushman Bharat scheme expands insurance coverage, compelling public hospitals to stretch fixed budgets, thereby elevating reprocessing in procurement tenders starting 2026 . South Korea and Australia, both early electron-beam sterilization adopters, pilot AI-tracked catheter reuse to meet national zero-waste targets by 2035 .
Europe's outlook is tempered by Article 17 fragmentation that introduces divergent reprocessing rules among member states, inflating compliance costs by up to 25% for cross-border operators . Germany's potential CE-reprocessing ban could remove USD 90 million in annual revenue if enacted in 2026, although Denmark and the Netherlands have issued guidance enabling reprocessing under strict quality-management oversight . The United Kingdom, outside EU frameworks, formally targets elimination of avoidable single-use medical goods by 2045, positioning reprocessing as a central compliance mechanism . France's health ministry launched a limited pilot in 2024 to evaluate duodenoscope reprocessing economics, possibly informing national policy in 2027 .