
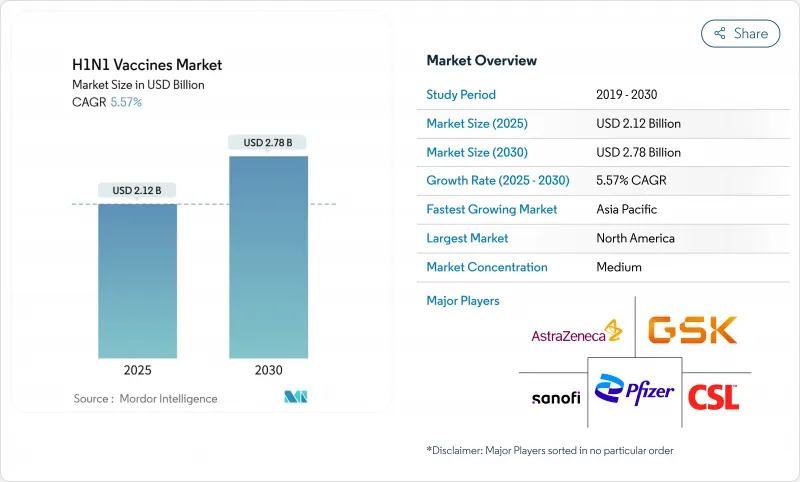
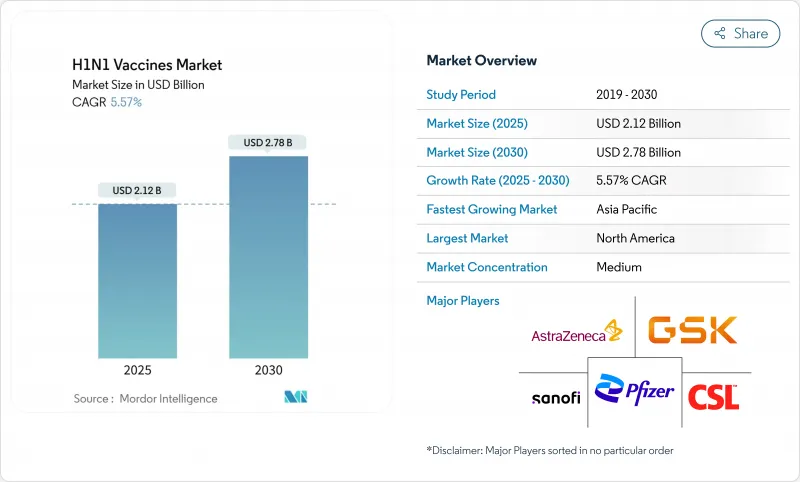
H1N1 백신 시장은 2025년에 21억 2,000만 달러, 2030년에는 27억 8,000만 달러에 이르고, CAGR 5.57%로 성장할 것으로 예상됩니다.
mRNA나 유전자 재조합 백신의 진보에 의해 개발 기간이 단축되고, 항원의 적합성이 향상되는 한편, 유행의 파나 면역력의 저하가 반복되기 때문에 매년의 재제조가 필요하기 때문에 수요는 여전히 탄력적입니다. 만기에 따른 보충 사이클에 연동된 정부의 비축 의무화는 예측 가능한 조달을 가능하게 하고, 국내 생산 능력에 대한 20억 달러를 넘는 투자는 급증 준비를 강화합니다. 약독생 백신과 유전자 재조합 제품은 기세를 늘리고 있지만, 불활성화 백신이나 계란을 기반으로 한 백신은 대규모 제조 거점과 확립된 안전성 프로파일에 의해 계속 주류가 되고 있습니다. 지역별로는 북미가 BARDA의 자금 지원과 확립된 유통망을 배경으로 선도하고 있는 한편, 아시아태평양은 제조 거점의 확대와 의료 예산 증가에 따라 급성장하고 있습니다.
2024-2025년 시즌에는 인플루엔자 A형 H1N1이 주류가 되어, 기록적인 입원 환자가 발생하기 때문에 의료 시스템에의 부담을 막기 위해서 매년 백신 접종을 실시할 필요성이 재확인됩니다. 2023-2024년의 백신 유효율은 42%로 떨어졌으며, 일관된 재접종 사이클을 촉진하는 면역력의 저하가 부각되었습니다. 2024년 8월 베트남에서 발생한 돼지 유래 H1N1 환자와 같은 인수 공통 감염의 파급은 유행에 대비하는 것을 항상 정책 과제로 삼고 있습니다. 브라질과 스페인에서 발견된 돌연변이 형태는 세계적인 감시와 신속한 주식 갱신의 중요성을 강조합니다. 이러한 위협이 반복됨에 따라 수익 흐름이 안정되고 적응에 소요되는 시간을 단축하기 위한 플랫폼 투자가 촉진됩니다.
mRNA, 유전자 재조합, 세포 기반 시스템은 현재 난자 기반 우위에 도전하고 있습니다. Moderna의 mRNA-1083 3단계 데이터는 냉장고 보관을 허용하면서 승인된 비교 대상보다 강한 면역 반응을 보였습니다. 미국 정부가 Modernna의 유행 독감 프로그램에 대한 1억 7,600만 달러의 보조금은 차세대 플랫폼에 대한 미국 정부의 헌신을 보여줍니다. CSL Seqirus에 의한 세포 기반 생산은 연령대를 넘어서는 효능을 향상시키고 난자 적응 드리프트를 피했습니다. 재조합 접근법은 리드 타임을 단축하고 최근 H5N1 발생에서 강조된 가금류 공급 취약성을 피합니다. 조기 도입 기업은 민첩하고 우위를 차지하고 레거시 기업은 업그레이드를 촉구합니다.
인도에서는 2025년 21% 성장이 예상되더라도 성인 백신의 접종률은 1.5%에 불과하며 신흥 경제권의 경제적 부담의 크기를 보여주고 있습니다. 미국 메디케어의 2025년 최종규칙에서는 농촌의 클리닉에서 관리비로 33.71달러가 설정되었습니다. LMIC 시나리오의 88%에서 경제 모델은 예방 접종의 비용 효과를 보여주지만 예산 제약은 예방 접종의 도입을 늦추고 있습니다. 고용주가 시설 내 진료를 추진하고 있기 때문에 민간 부문에서의 접종율은 CAGR 6.39%로 상승하고 있지만, 고가의 혼합 백신의 상환에는 아직 고전하고 있습니다. 강력한 임상적 가치 제안에도 불구하고 접근 과제는 보급을 늦추고 있습니다.
불활성화 백신은 2024년 신형 인플루엔자 백신 시장의 86.12%를 차지하고 수십년에 걸친 안전성 데이터를 기반으로 구축된 집단 프로그램에서 그 역할이 정착하고 있음을 뒷받침하고 있습니다. 그러나 약독화 제제는 경비 투여와 강력한 점막 면역에 의해 2030년까지 연평균 복합 성장률(CAGR)이 가장 빠른 6.23%가 됩니다. 혈청 연구소가 2009년 유행에 250만 명 이상을 투여한 Nasovac(R)은 약독 생 제제의 대규모 사용을 입증했습니다. 2024년부터 2025년까지의 3가 조성으로의 전환에 따른 규제상의 무결성은 양쪽 제품 클래스에 동일하게 영향을 미치고, B/Yamagata를 사용하지 않는 균주 선택의 개량을 제조업체에 촉구하고 있습니다. 소아와 주사 바늘을 싫어하는 성인들 사이에서는 비강 내 형식을 점점 선호되고 있으며,이 부문의 기세를 가속화하고 있습니다.
약독생백신 제조업체는 자원이 적은 상황에서 유리한 편의성과 필요한 인력 감소를 강조함으로써 차별화를 도모하고 있습니다. 시판 후의 데이터에서는 안전성 프로파일이 양호한 것이 확인되고 있어 보다 넓은 연령층으로의 확대를 뒷받침하고 있습니다. 회귀 위험에 대한 규제 당국의 경계에도 불구하고, 항원 갱신에서의 이 부문의 민첩성은 신속한 대응이 중요한 경우에 점유율을 확대하는 입장에 있습니다. 그 결과, 비활성화 제제가 계절성 캠페인의 기간제품인 것을 계속하더라도, 경비제제에 중점을 둔 시장 진출기업이 판매량 증가를 획득할 가능성이 있습니다.
2024년 H1N1 백신 시장 점유율의 75.23%는 달걀 유래 제품이었으나 공급망과 항원 드리프트가 우려되는 가운데 2030년까지 연평균 복합 성장률(CAGR)은 6.21%를 유전자 재조합 백신 생산이 진행되고 있습니다. 재조합 시스템은 계란에 대한 적합성을 피할 수 있으므로 항원에 충실하고 신속한 스케일 업이 가능합니다. 버팔로 대학의 나노리포솜 헥사플렉스 후보는 현재 재조합형에 비해 우수한 H1N1 예방 효과를 보여줍니다. 세포 기반 기술은 중간 위치를 차지하고 있으며, 효능을 향상시키면서 기존의 규제적 전례를 유지함으로써 대규모 생산자의 채용을 용이하게 하고 있습니다.
WHO와 Gavi의 투자 프로그램은 신흥 시장으로의 기술 이전을 이끌고 공정한 유행 액세스를 위협하는 능력 격차를 줄이고 있습니다. 주요 유전 재조합 제제 제조업체는 유연한 단일 청소년 생물 반응기를 활용하여 시즌 간 신속한 전환에 기여합니다. 면역원성 개선에 대한 증거가 늘어남에 따라 보험 지불자는 적당한 보험료를 지불하게 되고, 재조합 제제나 세포 기반 후보 제제로의 점유율 변화가 점차 진행되고 있습니다.
2024년 H1N1 백신 시장은 북미가 40.44%의 점유율로 선도하고 있습니다. 이 지역은 CSL Seqirus의 홀리 스프링스 공장(6개월 이내에 1억 5,000만회 접종분을 생산 가능) 등 생산 능력 확대를 지원하는 20억 달러를 넘는 BARDA 계약의 혜택을 받고 있습니다. FDA에 의한 혼합 백신의 고속 트랙 지정은 승인을 가속화하고 최근 모데나의 mRNA 프로그램에 1억 7,600만 달러의 연방 자금이 제공되었다는 것은 기술적 리더십에 대한 지속적인 헌신을 보여줍니다. 그럼에도 불구하고 노인과 소아의 백신 섭취율이 떨어지기 때문에 공중 보건 목표에 문제가 있으며 새로운 교육 캠페인이 필요합니다.
아시아태평양은 CAGR 6.54%에서 가장 급성장하고 있는 지역으로, 현지 제조업에 대한 투자와 도시지역의 건강 의식 증가에 힘쓰고 있습니다. 인도의 2025년 인플루엔자 시장은 21% 확대되었으나 백신접종을 받은 45세 이상의 성인은 단 1.5%에 불과하며 잠재적인 가능성은 큽니다. 혈청연구소는 생산량을 30만회에서 100만회 이상으로 확대할 수 있어 지역 생산의 확장성을 보여줍니다. 중국은 외국의 임상 데이터를 점진적으로 인정하고 승인을 가속화하고 있으며, 한국의 적극적인 감시는 규제의 성숙을 보여줍니다.
유럽은 성숙하면서도 혁신적인 시장입니다. 2025년 1월에 발표된 EMA 지침은 업데이트된 균주의 승인을 간소화하고 관리 리드 타임을 단축하고 있습니다. 영국이 500만 인분의 유행 복용량을 구입한 것은 지속적인 준비를 강조하는 것이며 EU의 결속 기금은 국경을 넘어선 능력에 대한 투자를 뒷받침하는 것입니다. 신흥 지역에 비하면 성장은 둔화하고 있는 것, 배합제나 고용량 제제 수요가 수익을 지지하고 있습니다.
The H1N1 vaccines market is valued at USD 2.12 billion in 2025 and is forecast to reach USD 2.78 billion by 2030, advancing at a 5.57% CAGR.
Demand remains resilient because recurring epidemic waves and waning immunity require annual reformulation, while advances in mRNA and recombinant platforms shorten development timelines and improve antigen matching. Government stockpiling mandates tied to expiry-driven replenishment cycles anchor predictable procurement, and investments exceeding USD 2 billion in domestic capacity strengthen surge readiness. Live attenuated and recombinant products are gaining momentum, yet inactivated, egg-based vaccines continue to dominate due to large installed manufacturing bases and well-established safety profiles. Regionally, North America leads on the back of BARDA funding and established distribution networks, while Asia-Pacific posts the fastest growth as manufacturing hubs expand and healthcare budgets rise.
Record hospitalizations during the 2024-2025 season, with influenza A H1N1 as the dominant strain, reaffirm the need for yearly vaccination to prevent healthcare system stress. Vaccine effectiveness slipped to 42% in 2023-2024, highlighting immunity decay that fuels consistent revaccination cycles. Zoonotic spill-over events, such as Vietnam's swine-origin H1N1 case in August 2024, keep pandemic preparedness on policy agendas . Variant detections in Brazil and Spain underscore the importance of global surveillance and rapid strain updates. These recurring threats stabilize revenue streams and incentivize platform investments that cut adaptation time.
mRNA, recombinant, and cell-based systems now challenge egg-based dominance. Moderna's mRNA-1083 Phase 3 data showed stronger immune responses than licensed comparators while enabling refrigerator storage. The U.S. government's USD 176 million grant for Moderna's pandemic influenza program demonstrates institutional commitment to next-generation platforms. Cell-based production from CSL Seqirus improved effectiveness across age bands and avoided egg-adaptation drift . Recombinant approaches shorten lead times and bypass poultry supply vulnerabilities accentuated by recent H5N1 outbreaks. Early adopters gain agility advantages, prompting legacy players to upgrade or risk erosion.
Adult coverage in India remains only 1.5% despite 21% 2025 growth, showing affordability barriers in emerging economies. The U.S. Medicare 2025 final rule sets a USD 33.71 fee for administration in rural clinics, reflecting ongoing policy work to close payment gaps. Economic models in 88% of LMIC scenarios find vaccination cost-effective, yet budget constraints delay adoption. Private-sector uptake is rising at 6.39% CAGR as employers promote onsite clinics, but premium-priced combination vaccines still struggle for reimbursement. Access challenges slow penetration despite strong clinical value propositions.
Other drivers and restraints analyzed in the detailed report include:
For complete list of drivers and restraints, kindly check the Table Of Contents.
Inactivated vaccines accounted for 86.12% of the H1N1 vaccines market in 2024, confirming their entrenched role in mass programs built on decades of safety data. Live attenuated formulations, however, post the fastest 6.23% CAGR to 2030 as intranasal delivery and strong mucosal immunity enhance uptake. The Serum Institute's Nasovac(R) deployment to more than 2.5 million individuals during the 2009 pandemic validated large-scale live attenuated use. Regulatory alignment with the 2024-2025 move to trivalent compositions affects both product classes equally, pushing manufacturers to refine strain selection without B/Yamagata. Pediatric and needle-phobic adult populations increasingly favor intranasal formats, boosting segment momentum.
Live attenuated manufacturers differentiate by emphasizing convenience and reduced staffing needs, advantageous in low-resource contexts. Post-marketing data confirm favorable safety profiles, encouraging expansion into larger age brackets. Despite regulatory vigilance on reversion risks, the segment's agility in updating antigens positions it for share gains when rapid response is critical. Consequently, market entrants focusing on intranasal platforms may capture incremental volumes even as inactivated products remain the backbone of seasonal campaigns.
Egg-based production held 75.23% of the H1N1 vaccines market share in 2024, but recombinant platforms are advancing at a 6.21% CAGR through 2030 amid mounting supply-chain and antigenic drift concerns. Recombinant systems avoid egg adaptation, enabling closer antigen fidelity and quicker scale-up. The University at Buffalo's nanoliposome hexaplex candidate illustrates superior H1N1 protection over current recombinant comparators. Cell-based technologies occupy a middle ground, offering improved effectiveness yet retaining existing regulatory precedents, easing adoption for large producers.
Investment programs from WHO and Gavi are guiding technology transfer to emerging markets, narrowing capacity gaps that threaten equitable pandemic access. Leading recombinant manufacturers leverage flexible single-use bioreactors, contributing to faster changeover between seasons. As evidence grows on improved immunogenicity, payer willingness to reimburse at modest premiums supports a gradual share shift toward recombinant and cell-based candidates.
The H1N1 Vaccines Market is Segmented by Product Type (Inactivated Vaccine and Live Attenuated Vaccine), Technology (Egg-Based, Cell-Based, and More), Route of Administration (Intradermal, and More), Age Group (Pediatric, Adult, and Geriatric), Distribution Channel (Public and Private) and Geography (North America, Europe, Asia-Pacific, and More). The Market and Forecasts are Provided in Terms of Value (USD).
North America led the H1N1 vaccines market with a 40.44% share in 2024. The region benefits from BARDA contracts exceeding USD 2 billion that support capacity expansion, including CSL Seqirus's Holly Springs plant capable of producing 150 million doses within six months. FDA fast-track designations for combination vaccines accelerate approvals, and recent USD 176 million federal funding for Moderna's mRNA program signals sustained commitment to technological leadership. Nevertheless, declining uptake among seniors and children challenges public health targets, prompting renewed educational campaigns.
Asia-Pacific is the fastest-growing region at a 6.54% CAGR, propelled by local manufacturing investments and heightened urban health awareness. India's 2025 influenza market expanded 21%, though only 1.5% of adults aged 45+ were vaccinated, indicating vast latent potential. The Serum Institute can scale output from 300,000 to beyond 1 million doses, showcasing regional production scalability. China is gradually recognizing foreign clinical data to expedite approvals, while South Korea's active surveillance demonstrates regulatory maturity.
Europe represents a mature but innovative market. EMA guidance released in January 2025 streamlines updated strain approvals, cutting administrative lead times. The UK's purchase of 5 million pandemic doses underscores ongoing preparedness, and EU cohesion funds back cross-border capacity investments. While growth is slower than in emerging regions, demand for combination and high-dose products sustains revenue.