
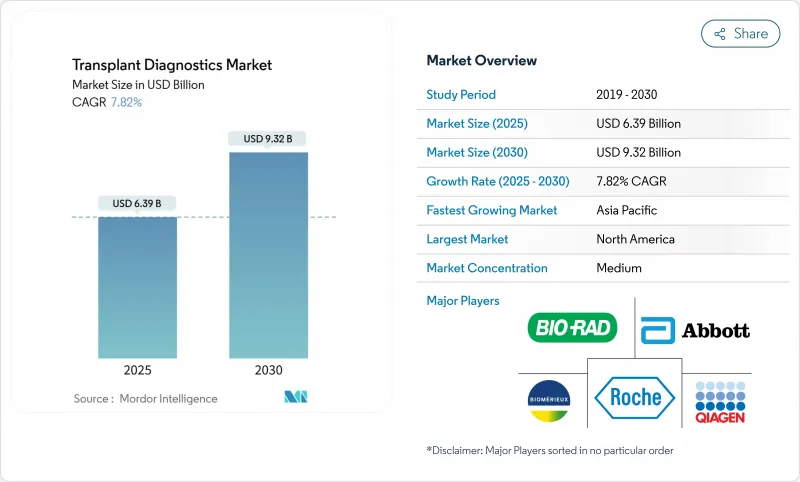
이식 진단 시장의 규모는 2025년에 63억 9,000만 달러, 2030년에는 93억 2,000만 달러에 이를 전망으로, CAGR 7.82%로 성장할 것으로 예측됩니다.

높은 이식 건수, NGS의 급속한 도입, AI 기반 의사결정 지원, 정밀의료에 대한 지불자의 인식 등이 결합되어 주요 검사 시설과 키트 공급업체 전체에서 두 자릿수의 수익 모멘텀을 유지하고 있습니다. 고해상도 HLA 시퀀싱은 소요 시간과 대립유전자 해상도의 결정적인 향상을 가져오며 소규모 프로그램의 자본 장벽을 낮추는 종량제 조달 모델을 뒷받침합니다. NGS 워크플로우가 유효한 라이브러리 키트를 필요로 하기 때문에 시약의 풀스루가 호조를 유지하는 한편, 예측적인 dd-cfDNA 감시가 루틴 후 침습적인 생검을 대체하고 있습니다. 진단제 제조업체와 이식 전문의는 분석, 자동화, 디지털 병리를 통합한 제품을 제공하기 위해 경쟁하고 있으며, 경쟁은 격화하고 있습니다.
미국의 병원에서는 2024년에 4만 8,000건 이상의 장기 이식이 실시되어, 전년 대비 3.3% 증가하였습니다. 순환 사후 이식은 현재 사망 기증자에 의한 이식의 36%를 차지하고 있으며 수혜자 풀이 확대되고 있습니다. 조혈 줄기 세포 이식의 기세는 고해상도 HLA 타이핑과 관련이 있으며, 부분적으로 불일치하는 기증자도 효과적이며 특히 다양한 민족의 환자에게 혜택을 줍니다. 폐는 연속적인 공급으로 이미 12개월 만에 이식률이 16% 상승하였습니다. 수술 건수가 증가할 때마다 적합성 검사, 수술 후 모니터링, 장기 거부 반응 감시에 대한 수요가 높아집니다. 그 결과, 이식 진단 시장은 지속적인 시약의 보급과 설치 기반의 이용 확대를 기록하고 있습니다.
NGS 플랫폼은 샘플 바코딩을 통해 여러 HLA 유전자좌의 고해상도 타이핑을 동시에 수행하고 처리량을 높이는 동시에 대립유전자 당 비용을 절감합니다. dd-cfDNA 분석은 현재 심장 수령인의 신호 상승 위험 비율이 2.56이기 때문에 조직 검사보다 빨리 이식 상해의 징후를 나타냅니다. 국가의 지불 기관은 생검 합병증의 감소로 인한 하류에서의 절약을 점점 더 인식하고 환급 승인을 가속화하고 있습니다. 시퀀서, 소프트웨어 및 소모품을 예측 가능한 샘플당 요금으로 번들하는 시약 임대 계약으로 실험실은 유연성을 확보하고 중견 센터에서 NGS의 보급을 뒷받침하고 있습니다.
종합적인 NGS 시스템은 유효성 검사 전에 50만 달러를 초과할 수 있으며 고급 시약은 샘플 당 400 달러에 달합니다. FDA의 임상 실험실 개발 검사 감독으로 10년 동안 12억 9,000만 달러에 가까운 컴플라이언스 비용이 소모되었습니다. 제한된 처리량 검사실은 이러한 비용을 감가 상각하기 위해 어려움을 겪고 있으며 대량 참조 센터와의 통합이 필요합니다. 비용의 압력은 dd-cfDNA 측정법에도 영향을 미치고, 지불자의 요금 체계가 분석법의 복잡성보다 지연되기 때문에 저소득 환경에서의 보급이 늦어지고 있습니다.
분자 분석은 타의 추종을 불허하는 대립유전자 해상도와 멀티플렉스 능력으로 2024년 이식진단 시장 점유율의 69.35%를 획득했습니다. 이 부문의 2030년까지의 CAGR은 7.9%이지만, 이는 추출, 라이브러리 전처리, 시퀀싱을 통합 데크에 집약하고, 작업 시간을 단축하는 랩의 자동화에 의한 이점입니다. 유동 세포 계측법 교차 매치와 같은 보완적인 비분자 검사는 여전히 긴급 사망 기증자 할당에 필수적이며 특수 이용 사례에서 CAGR 12.25%의 성장을 이루고 있습니다.
dd-cfDNA 키트를 동일한 시퀀서에 중첩함으로써 환자 에피소드당 시약 소비량이 증가하고 분자 워크플로우의 이식 진단 시장 규모가 확대됩니다. 19년간의 벤치마크를 포괄하는 외부 숙련도 프로그램에 따르면, 유전자형의 일치율은 꾸준히 상승하고 있으며, 이는 기술의 성숙도를 뒷받침하고 있습니다.
시약 및 소모품은 2024년에도 65.53%의 점유율로 수익의 주축으로 유지되었습니다. 이는 NGS를 수행할 때마다 바코드가 달린 프라이머, 폴리머라제 및 캡처 프로브가 소비되기 때문입니다. 한편, 소프트웨어와 애널리틱스는 CAGR 13.85%로 성장을 지속하고 있으며, 알고리즘이 QC, 페이딩, 임상 보고를 자동화하기 때문에 디지털 서비스의 이식 진단 시장 규모가 확대될 것으로 예측됩니다.
클라우드 네이티브 플랫폼은 On-Premise 인프라의 필요성을 줄이고 세계에서 대립유전자의 제출마다 업데이트되는 실시간 변형 데이터베이스를 지원합니다. 장비는 사용 기반 임대로 이동하여 자본 투자가 운영 예산으로 투입되며 하드웨어 성장이 억제됩니다. 공급업체는 AI 라이선스를 시약 키트에 번들하여 데이터 구독을 모든 분석주기에 통합하여 경상 수익을 얻습니다.
북미는 종합적인 메디케어 정책, 4만 8,000건의 이식 수술, dd-cfDNA 모니터링을 일상적으로 전개하는 고밀도 센터 네트워크를 통해 2024년 세계 매출의 42.82%를 차지했습니다. AI분석장치의 보급과 조기 환급 결정이 한 자릿수 중반의 단가 프리미엄을 지원하고 있습니다. FDA에 의한 LDT 규제는 소규모 시설에 타격을 줄 수 있으며 규모 효율성이 우수한 국립 검사 시설로의 아웃소싱을 촉진합니다.
그러나 GDPR(EU 개인정보보호규정)은 희귀 대립유전자 데이터의 교환을 제한하고, 다시설 공동 연구의 설계를 복잡하게 하고, 바이오마커의 검증을 지연시킵니다. 의료기술평가기관은 임상결과 데이터의 연장을 요구하는 경우가 많으며, 벤더의 투자회수기간을 연장하고 있습니다. 그럼에도 불구하고 인구 고령화와 고형 장기 대기자 수 증가로 검사 건수가 견조하게 추이하고 있습니다.
아시아태평양은 CAGR 11.61%로 가장 급속히 확대하고 있으며, 일본이 유전자 편집 이종 이식 준비 태세를 개척하고 인도가 1년 생존율 85-90%를 벤치마크로 이식 능력을 확대하고 있습니다. 각국 정부는 바이오프린팅과 NGS의 현지 제조에 투자하여 수입 의존도를 줄이고 시약에 대한 접근성을 높이고 있습니다. 대규모 집단의 다양한 HLA 프로파일은 고해상도 제노유형 수요를 더욱 높여 이식 진단 시장을 확대합니다.
The transplant diagnostics market size stands at USD 6.39 billion in 2025 and is forecast to reach USD 9.32 billion by 2030, advancing at a 7.82% CAGR.
Robust transplant volumes, rapid NGS adoption, AI-driven decision support, and payer recognition of precision medicine collectively sustain double-digit revenue momentum across major laboratories and kit suppliers. High-resolution HLA sequencing delivers decisive gains in turnaround times and allelic resolution, encouraging pay-per-use procurement models that lower capital barriers for smaller programs. Reagent pull-through remains strong because NGS workflows require validated library kits, while predictive dd-cfDNA surveillance is displacing invasive biopsies in routine follow-up. Competitive intensity is rising as diagnostics majors and transplant-focused specialists race to integrate analytics, automation, and digital pathology into unified offerings.
US hospitals performed 48,000-plus organ transplants in 2024, a 3.3% rise that mirrors broader global gains. Donation-after-circulatory-death grafts now contribute 36% of deceased-donor procedures, expanding the recipient pool. Parallel momentum in hematopoietic stem-cell transplants is linked to high-resolution HLA typing that validates partially mismatched donors, especially benefitting ethnically diverse patients. Continuous distribution for lungs has already lifted transplant rates 16% within 12 months. Each increment in procedure volume converts into higher demand for compatibility assays, post-operative monitoring, and longitudinal rejection surveillance. Consequently, the transplant diagnostics market records sustained reagent pull-through and greater installed-base utilization.
NGS platforms provide simultaneous high-resolution typing of multiple HLA loci via sample barcoding, boosting throughput while cutting cost per allele. dd-cfDNA assays now flag graft injury earlier than histology, with hazard ratios of 2.56 for elevated signals in heart recipients. National payers increasingly recognize the downstream savings from fewer biopsy complications, accelerating reimbursement approvals. Laboratories gain flexibility through reagent-rental contracts that bundle sequencers, software, and consumables into predictable per-sample fees, propelling wider NGS adoption across mid-tier centers.
Comprehensive NGS systems can exceed USD 500,000 before validation, while premium reagents reach USD 400 per sample aruplab.com. FDA oversight of Laboratory-Developed Tests adds compliance expenditures near USD 1.29 billion over 10 years. Laboratories with limited throughput struggle to amortize these expenses, prompting consolidation toward high-volume reference centers. Cost pressure also affects dd-cfDNA assays where payer fee schedules lag analytical complexity, delaying widespread roll-out in low-income settings.
Other drivers and restraints analyzed in the detailed report include:
For complete list of drivers and restraints, kindly check the Table Of Contents.
Molecular assays captured 69.35% of transplant diagnostics market share in 2024 owing to unrivaled allelic resolution and multiplex capacity. The segment's 7.9% CAGR through 2030 benefits from lab automation that consolidates extraction, library prep, and sequencing on unified decks, shortening hands-on time. Complementary non-molecular tests such as flow-cytometric crossmatch remain indispensable for urgent deceased-donor allocation, growing 12.25% CAGR on specialized use cases.
Platform enhancements now merge NGS reads with AI-based imputation to reconcile ambiguous alleles, raising call confidence in under-sequenced regions. dd-cfDNA kits layered on the same sequencers raise reagent consumption per patient episode, lifting the transplant diagnostics market size for molecular workflows. External proficiency programs covering 19 years of benchmarking show genotype concordance steadily increasing, underscoring technology maturity.
Reagents and consumables remained the revenue anchor with 65.53% share in 2024 because every NGS run consumes barcoded primers, polymerases, and capture probes. Yet software and analytics is expected to post 13.85% CAGR, expanding the transplant diagnostics market size for digital services as algorithms automate QC, phasing, and clinical reporting.
Cloud-native platforms reduce on-premise infrastructure needs and support real-time variant databases that update with each global allele submission. Instruments shift toward usage-based leases, reallocating capex to operating budgets and dampening hardware growth. Vendors bundle AI licenses with reagent kits, embedding data subscriptions into every assay cycle to capture recurring revenue.
The Transplant Diagnostics Market Report is Segmented by Technology (Molecular and Non-Molecular), Product (Instrument, Reagents, and More), Transplant Type (Solid Organ, Stem Cell, and Soft Tissue), Application (Diagnostic and Research), End User (Independent Reference Laboratories, and More), and Geography (North America, Europe, Asia-Pacific, and More). The Market Forecasts are Provided in Terms of Value (USD).
North America held 42.82% of global revenue in 2024 due to comprehensive Medicare policies, 48,000 transplant procedures, and dense center networks that routinely deploy dd-cfDNA monitoring. Widespread adoption of AI analyzers and early reimbursement decisions support mid-single-digit unit price premiums. FDA regulation of LDTs may pinch smaller facilities, provoking outsourcing to national reference laboratories that command scale efficiencies.
Europe presents mature infrastructure with harmonized quality schemes; however, GDPR limits rare-allele data exchange, complicating multicenter study design and slowing biomarker validation. Health-technology-assessment bodies often request extended clinical outcome data, extending payback periods for vendors. Nonetheless, population aging and rising solid-organ waitlists sustain steady test volumes.
Asia-Pacific registers the fastest expansion at 11.61% CAGR as Japan pioneers gene-edited xenograft readiness and India scales transplant capacity with 85-90% one-year survival benchmarks. Governments invest in local bioprinting and NGS manufacturing to mitigate import dependence, amplifying reagent accessibility. Diverse HLA profiles across large populations further elevate demand for high-resolution genotyping, expanding the transplant diagnostics market.